【特別講座】[5.5]-P-スピロ型キラルテトラアミノホスホニウム塩を用いる触媒的分子変換
本記事は、OrganicSquare Vol.59 (2017年3月号)において、名古屋大学 浦口 大輔様、大井 貴史様に執筆いただいたものです。
はじめに
キラル相間移動触媒としての歴史をもつアンモニウム塩とは対照的に、ホスホニウム塩を触媒的に利用した例はほとんど知られていない 1-3)。これは、ホスホニウムイオンが反応中間体や合成試剤として高い反応性をもつことと密接に関係している。つまり、一般的な反応条件下における分子の安定性が低いことが、ホスホニウム塩を触媒とするシステムの構築を妨げてきた。
これに対し我々は、高い安定性を備えた分子構造としてテトラアミノホスホニウム塩に着目し、従来にないオニウム塩の触媒機能の創出を目指して研究を行ってきた 4)。テトラアミノホスホニウムイオンは、不安定なリン-炭素結合を有するホスホニウムイオンとは異なり、電荷が分散し安定な PN4 骨格が中核を成すことに加え窒素上の置換基による中心リン原子周りのかさ高さゆえに、極めて強い塩基性条件下でも安定である 5)。
また、対応するアミンと五塩化リンのような卑近なリン源から一段階で分子の基本骨格を容易に合成できるため、多様な構造を備えた触媒ライブラリ構築に有利である(式1)6)。さらに、第一級アミンから合成した分子はユニークなHN-P+-NH 構造をもち、これがアニオンに対する二重水素結合供与能を示す 7)。
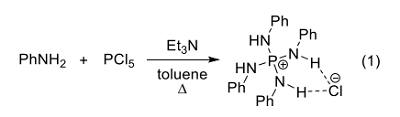
[5.5]-P-スピロ型トリアミノイミノホスホラン
我々は、このようなテトラアミノホスホニウムイオンの特徴と、その共役塩基であるトリアミノイミノホスホランすなわち P1 ホスファゼン(Schwesinger 塩基)8-10)の強塩基性の利用を念頭に、構造が剛直で水素結合の角度も調節可能なスピロ環を核とした光学活性触媒の分子設計を行った。具体的には、L-アミノ酸から簡便に得られる 1,2-ジアミンと五塩化リンから合成できる、[5.5]-P-スピロ型ホスホニウム塩を設計・合成した(式2)11-13)。
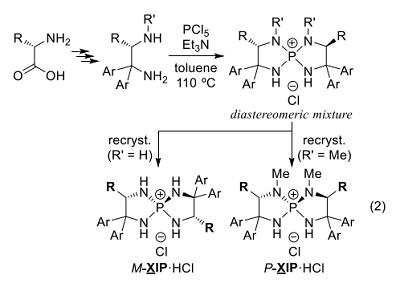
本ホスホニウム塩はスピロキラリティーに基づくジアステレオマーの混合物として得られるが、カラムクロマトグラフィーの後に再結晶すると単一のジアステレオマーを単離できる。また一般に、アミノ酸由来の窒素上に置換基をもたないジアミンからは M 体、メチル基をもつものからは P 体の塩が優先して生成する。
以降、本稿ではこれらの塩をそれぞれ、原料のアミノ酸の一文字表記(X)に対して M-XIP·HCl、P-XIP·HCl と表記させていただく。
M-VIP·HCl を用いる触媒的分子変換
M-XIP·HCl は、低温下で KOtBu のような強塩基を作用させることで、有機塩基触媒として高い性能を示すイミノホスホラン M-XIP に定量的に変換できる。
例えば、L-バリン誘導体である M-VIP·HCl (Ar = 4-CF3C6H4 or 4-MeC6H4)はニトロアルカンとアルデヒドの Henry 反応に有効な触媒として働き、極めて高い立体選択性を与える 11)。特に、低級ニトロアルカンと芳香族および α,β-不飽和アルデヒドやイナールを基質としたときに、ほぼ完全なエナンチオおよびジアステレオ選択性を発現する(式3)11,14)。
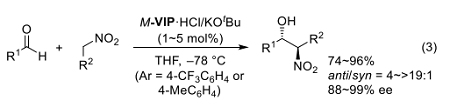
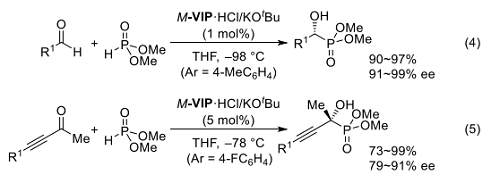
i本反応では当初、M-VIP·H によるニトロナートの認識が選択性発現の鍵と想定していたが、最近の計算科学的解析により M-VIP·H がアニオンとアルデヒドを二つの N-H 水素によってそれぞれ捕捉した環状遷移状態を組織できることの重要性が明らかにされている 15)。一方、M-VIP がジアルキルホスホネートを脱プロトン化するために十分な pKa をもつことを利用すれば、ホスホネートイオンの生成を伴ったカルボニル化合物へのヒドロホスホリル化の効率を著しく改善できる(式4)16)。
M-VIP (Ar = 4-FC6H4)を使うことで、従来の Lewis 酸触媒では十分な活性が得られない、シンプルなケトンに対する高エナンチオ選択的なヒドロホスホリル化が速やかに進行することは、本触媒系のひとつの特徴といえる(式5)17)。
P-XIP·HCl を用いる触媒的分子変換
アミノ酸に由来する窒素をメチル化したイミノホスホラン P-XIP は、P-XIP·HClのメタノール溶液を -OH 型の陰イオン交換樹脂のカラムに通すことで調製し、保存可能な固体として単離できる。アミンなどと同様に二酸化炭素などの酸性ガスによる失活が起こるものの、比較的安定な化合物として室温・空気下で取り扱い得る。
L-ロイシンから合成したイミノホスホラン P-LIP は、アミノ酸エノラート等価体を与えるアズラクトンを求核種とする位置選択的かつ立体選択的な共役付加反応に有効である。具体的には、δ 位に置換基をもつジエニルアシルピロール(n = 0)への付加反応において P-LIP (Ar = 4-FC6H4)を触媒とすると、ほぼ完全な 1,6 選択性とジアステレオ・エナンチオ選択性が発現する(式6)18)。
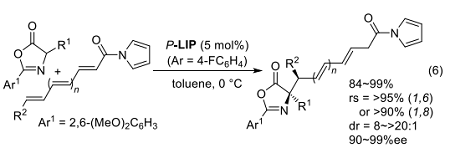
さらに、トリエン(n = 1)を基質とすれば 1,8 選択的に反応が進行し、対応する付加体が良好な収率で得られる。反応性の似通った二つあるいは三つの反応点の区別が必要な本反応から単一の生成物が優先して生じる理由について計算科学的な手法を用いて検討し、上記の Henry 反応と同様に P-LIP·H が組織する環状遷移状態の形が鍵を握ることを示唆する結果を得ている 19)。
P-XIP·H による遷移状態制御は、炭素-炭素結合形成反応における立体選択性獲得のみならず、生成物前駆体アニオンへのプロトン化でも力を発揮する。カルボニルと共役した三重結合への付加反応では中間体としてアレン型エノラートが生じ、引き続くプロトン化の方向に基づいて、生成する二重結合の幾何異性が決定される。
イミノホスホランは、従来の触媒系で問題とされてきたこの段階を高いレベルで制御できる。例えば、メチルプロピオレートへの付加では、M-VIP·HCl (Ar = 4-CF3C6H4)/KOtBu が Z 付加体を与えるのに対し、L-イソロイシン誘導体の P-IIP (Ar = Ph)を触媒とすると E 付加体を選択的に生じる(式7)20)。
これらの選択性が立体的要因ではなく遷移状態制御に基づくものであることは、シアノアセチレンおよび末端置換型のアルキニルカルボニル(式8)21)への付加においてもほぼ純粋な幾何異性体が得られてくることからも示唆される。
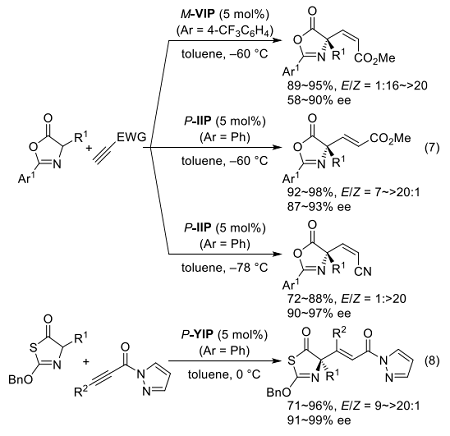
共役付加における P-XIP·H の高い立体制御能は、ニトロナートのビニルスルホンへの付加においても発揮され、形式的なニトロアルカンのα-アリル化反応の実現へとつながっている 22)。
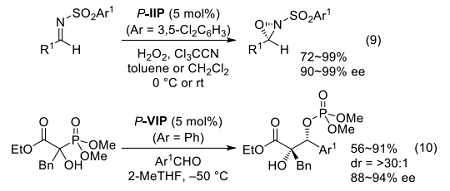
イミノホスホランの強塩基性を利用すると、水酸基のような比較的 pKa の高い官能基からの脱プロトン化を伴った分子変換を設計できる。過酸化水素に P-IIP (Ar = 3,5-Cl2C6H3)を作用させると、対応するホスホニウム塩 P-IIP·HOOH (Ar = 3,5-Cl2C6H3)が速やかに生じ、ヒドロペルオキシドイオンの高い求核力を利用した酸化反応への展開が望める。
実際、トリクロロアセトニトリルを共存させる Payne 型の条件下、N-スルホニルイミンの酸化が高エナンチオ選択的に進行する(式9)23-25)。さらに、α-ヒドロキシホスホン酸エステルからの脱プロトン化により、ホスファ Brook 転位を経てグリコレートエノラートを生成させ得ることを見出し、触媒量の P-VIP (Ar = Ph)を用いる高立体選択的なアルドール反応を達成した(式10)26)。本反応は、その後の形式的なクロスピナコールカップリング反応の開発への基盤となる成果となった 27)。
一方で、P-XIP·H は対イオンとして有機アニオンを備えた塩としても安定に単離でき、キラルカチオンと有機アニオンがそれぞれ独立の役割を果たすイオン対協奏型触媒系に適用できる 13)。この研究の過程で発見した、P-XIP·H の水素結合ネットワークを組織する力に基づく自発的な超分子型イオン対形成現象は、本触媒系を特徴づけるものといえる 28,29)。
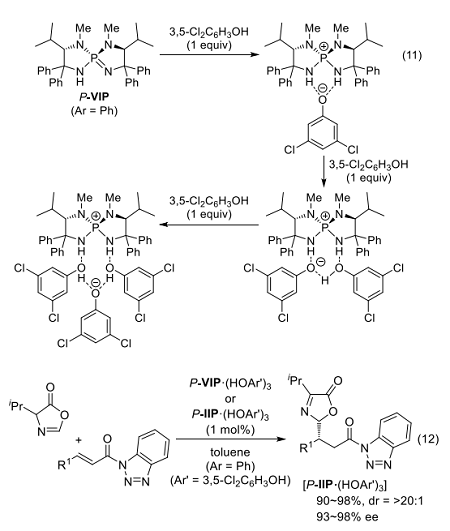
具体的には、P-VIP にフェノール誘導体(Ar'OH)を作用させると P-VIP·(HOAr')1~3 が当量比に応じて選択的に生成することを低温 31P NMR により観測し、3種類のイオン対がそれぞれ単結晶として単離できる安定性をもつことを見出した(式11)29)。
さらに、3つのイオン対が2位に置換基をもたないアズラクトンのγ選択的共役付加において塩基触媒として働き、それぞれ構造に応じた選択性を示すことを明らかにした(式12)。このとき、キラルカチオンの構造のみならずフェノール誘導体の構造も立体選択性に影響を与えるという知見は重要である 28)。
すなわち、一般的なホスホニウムエノラートと求電子種からなる単純な遷移状態ではなく、イオン対形成には本来無関係なフェノール誘導体が取り込まれた超分子型の遷移状態の関与が想定される。
本超分子型イオン対触媒系においては、分子集合の程度を溶媒の極性によっても調節できることを低温 31P NMR 分析により確認しており、この性質はニトロオレフィンへの不斉共役付加反応の開発に活かすことができる 30)。
今後の展望
トリアミノイミノホスホランは、1980 年代に Schwesinger らにより合成された長い歴史をもつ分子であるにもかかわらず、その不斉触媒としての可能性は未開拓であった。本研究を通して、共役酸であるホスホニウムイオンの水素結合供与能が反応の遷移状態の精密制御を可能にし、結合形成において高い選択性が発現することが実証されたことは、キラル有機塩基触媒の開発研究に新たな可能性を拓くものとなった。
実際、我々の報告を契機に二官能性のイミノホスホラン触媒 31-35)や [7.7]-スピロ型ビスグアニジノホスファゼン 36,37)が生み出され、高い触媒機能が利用されるようになってきている。今後は、さらに多様な分子構造を備えたキラルなイミノホスホラン/アミノホスホニウム塩が開発され、新たな分子変換の創出へとつながっていくものと期待される。
参考文献
- Asymmetric Phase Transfer Catalysis, Maruoka, K. Ed., Wiley-VCH: Weinheim, 2008.
- Werner, T.: Adv. Synth. Catal. 351, 1469 (2009). DOI: 10.1002/adsc.200900211
- Enders, D., Nguyen, T. V.: Org. Biomol. Chem. 10, 5327 (2012). DOI: 10.1039/C2OB25823D
- Uraguchi, D., Ooi, T.: J. Synth. Org. Chem. Jpn. 68, 1185 (2010). DOI: 10.5059/yukigoseikyokaishi.68.1185
- Schwesinger, R., Link, R., Wenzl, P., Kossek, S., Keller, M.: Chem. Eur. J. 12, 429 (2006). DOI: 10.1002/chem.200500837
- Cameron, T. B., Hanson, H. N., de la Fuente, G. F., Huheey, J. E.: Phosphorus, Sulfur, Silicon, 78, 37 (1993). DOI: 10.1080/10426509308032420
- Bickley, J. F., Copsey, M. C., Jeffery, J. C., Leedham, A. P., Russell, C. A., Stalke, D., Steiner, A., Stey,T., Zacchini,S.: Dalton Trans. 989 (2004). DOI: 10.1039/B400798K
- Krawczyk, H., Dzięgielewski, M., Deredas, D., Albrecht, A., Albrecht, Ł.: Chem. Eur. J., 21, 10268 (2015). DOI: 10.1002/chem.201500481
- Superbases for Organic Synthesis: Guanidines, Amidines, Phosphazenes and Related Organocatalysts, Ishikawa, T. Ed., John Wiley & Sons, West Sussex, 2009.
- Schwesinger, R., Schlemper, H.: Angew. Chem. Int. Ed. Engl., 26, 1167 (1987). DOI: 10.1002/anie.198711671
- Uraguchi, D., Sakaki, S., Ooi, T.: J. Am. Chem. Soc., 129, 12392 (2007). DOI: 10.1021/ja075152+
- Uraguchi, D., Sakaki, S., Ueki, Y., Ito, T., Ooi,T.: Heterocycles 76, 1081 (2008). DOI: 10.3987/COM-08-S(N)123
- Uraguchi, D., Ueki, Y., Ooi,T.: J. Am. Chem. Soc., 130, 14088 (2008). DOI: 10.1021/ja806311e
- Uraguchi, D., Nakamura, S., Ooi, T.: Angew. Chem. Int. Ed. 49, 7562 (2010). DOI: 10.1002/anie.201004072
- Simón, L.,Paton,R.S.: J. Org. Chem. 80, 2756 (2015). DOI: 10.1021/acs.joc.5b00063
- Uraguchi, D., Ito, T., Ooi, T.: J. Am. Chem. Soc. 131, 3836 (2009). DOI: 10.1021/ja810043d
- Uraguchi, D., Ito, T., Nakamura, S., Ooi, T.: Chem. Sci. 1, 488 (2010). DOI: 10.1039/C0SC00268B
- Uraguchi, D., Yoshioka, K., Ueki, Y., Ooi, T.: J. Am. Chem. Soc. 134, 19370 (2012). DOI: 10.1021/ja310209g
- Yamanaka, M., Sakata, K., Yoshioka, K., Uraguchi, D., Ooi, T.: J. Org. Chem. 82, 541 (2017). DOI: 10.1021/acs.joc.6b02572
- Uraguchi, D., Ueki, Y., Sugiyama, A., Ooi, T.: Chem. Sci. 4, 1308 (2013). DOI: 10.1039/C2SC22027J
- Uraguchi, D., Yamada, K., Ooi, T.: Angew. Chem. Int. Ed. 54, 9954 (2015). DOI: 10.1002/anie.201503928
- Uraguchi, D., Nakamura, S., Sasaki, H., Konakade, Y., Ooi, T.: Chem. Commun. 50, 3491 (2014). DOI: 10.1039/C3CC49477B
- Uraguchi, D., Tsutsumi, R., Ooi, T.: J. Am. Chem. Soc. 135, 8161 (2013). DOI: 10.1021/ja403491j
- Uraguchi, D., Tsutsumi, R., Ooi, T.: Tetrahedron, 70, 1691 (2014). DOI: 10.1016/j.tet.2013.12.086
- Tsutsumi, R., Kim, S., Uraguchi, D., Ooi, T.: Synthesis, 46, 871 (2014). DOI: 10.1055/s-0033-1340818
- Corbett, M. T., Uraguchi, D., Ooi, T., Johnson, J. S.: Angew. Chem. Int. Ed. 51, 4685 (2012). DOI: 10.1002/anie.201200559
- Horwitz, M. A., Tanaka, N., Yokosaka, T., Uraguchi, D., Johnson, J. S., Ooi, T.: Chem. Sci. 6, 6086 (2015). DOI: 10.1039/C5SC02170G
- Uraguchi, D., Ueki, Y., Ooi, T.: Science, 326, 120 (2009). DOI: 10.1126/science.1176758
- Uraguchi, D., Ueki, Y., Ooi, T.: Angew. Chem. Int. Ed. 50, 3681 (2011). DOI: 10.1002/anie.201007752
- Uraguchi, D., Ueki, Y., Ooi, T.: Chem. Sci. 3, 842 (2012). DOI: 10.1039/C1SC00678A
- Núñez, M. G., Farley, A. J. M., Dixon, D. J.: J. Am. Chem. Soc. 135, 16348 (2013). DOI: 10.1021/ja409121s
- Robertson, G. P., Farley, A. J. M., Dixon, D. J.: Synlett, 27, 21 (2016). DOI: 10.1055/s-0035-1560530
- Farley, A. J. M., Sandford, C., Dixon, D. J.: J. Am. Chem. Soc. 137, 15992 (2015). DOI: 10.1021/jacs.5b10226
- Goldys, A. M., Núñez, M. G., Dixon, D. J.: Org. Lett. 16, 6294 (2014). DOI: 10.1021/ol5029942
- Yang, J., Farley, A. J. M., Dixon, D. J.: Chem. Sci. 8, 606 (2017). DOI: 10.1039/C6SC02878K
- Takeda, T., Terada, M.: J. Am. Chem. Soc. 135, 15306 (2013). DOI: 10.1021/ja408296h
- Kondoh, A., Oishi, M., Takeda, T., Terada, M.: Angew. Chem. Int. Ed. 54, 15836 (2015). DOI: 10.1002/anie.201508178




