【総説】高活性第 1 級アルコール酸化触媒:DMN-AZADO
本記事は、和光純薬時報 Vol.84 No.1(2016年1月号)において、名古屋大学大学院創薬科学研究科 澁谷 正俊先生、東北大学大学院薬学研究科 岩渕 好治先生に執筆いただいたものです。

はじめに
有機ニトロキシラジカル TEMPO を触媒とするアルコールの酸化反応では、基質中に第 1 級アルコールと第 2 級アルコールが共存する場合、第 1 級アルコールが選択的に酸化されることが知られている。
高度に酸素官能基化された天然物や生物活性化合物の合成では、しばしば複数の水酸基を持つ基質の特定の水酸基のみを選択的に変換する必要がある。このような場合、通常保護基を用いて目的以外の水酸基をマスクすることで、目的水酸基のみを選択的に変換する。
しかしながら、多数の官能基を持つ複雑な化合物を合成する場合、保護基の化学のみではしばしば所望の選択的変換を実現することが困難となる。また、保護基の使用は、保護・脱保護の工程が必要となるため工程数の増加や収率低下を招く原因ともなる。
TEMPO(1)による第 1 級アルコール選択的酸化反応は、複数の水酸基の区別化法として近年、有機合成において広く用いられ、このような問題の有力な解決法となっている(Scheme 1)。その一方で、第 1 級アルコール選択的酸化反応は、TEMPO 酸化のみといっても良い状況であるため、TEMPO 酸化で目的の変換が効率的に進行しない場合は、合成戦略の変更を余儀なくされる。
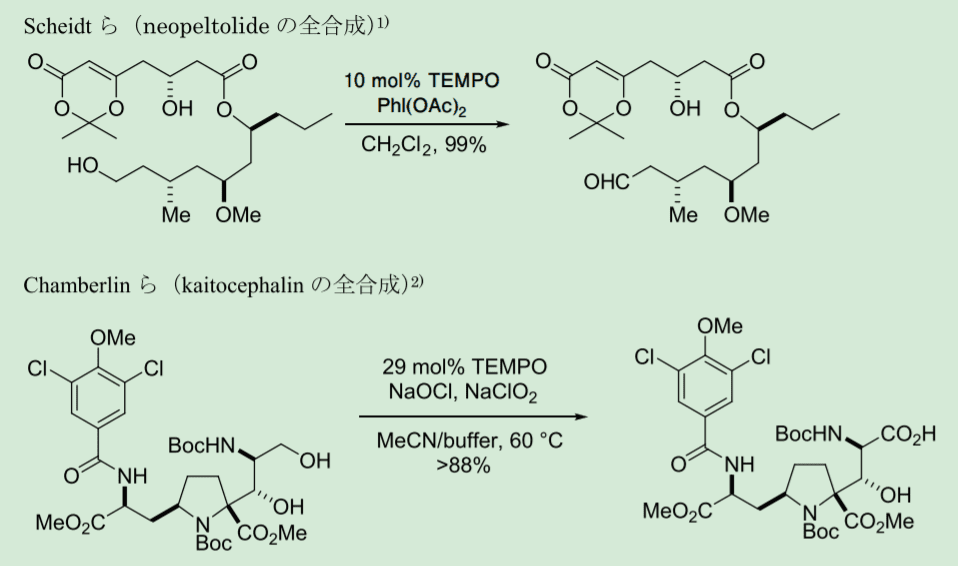
Scheme 1. TEMPO-catalyzed selective oxidation of primary alcohols
従って、そのような場合に TEMPO(1)の代替となる触媒が開発できれば、第 1 級アルコール選択的酸化反応による合成戦略をより確かなものとすることができる。
私たちは、これまでアザアダマンタン型有機ニトロキシラジカル AZADO(2)、1-Me-AZADO(3)およびアザノルアダマンタン型有機ニトロキシラジカル Nor-AZADO(4)を始めとする高活性触媒の開発を行ってきた(Figure 1)3)-6)。
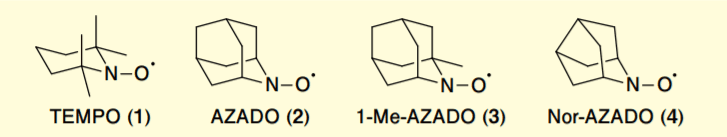
Figure 1. Structures of nitroxy radicals
これらの触媒は、ニトロキシラジカル α 位に水素原子を持つため TEMPO(1)に比べ触媒活性部位近傍に広い反応場を持つ。そのため、TEMPO(1)ではほとんど反応が進行しない立体障害の大きい第 2 級アルコールの酸化も速やかに進行する。
これらの触媒は天然物合成に広く適用されるようになってきた。Nicolaou らによる vannusal B の合成では、1-Me-AZADO(3)を用いたネオペンチル位の第 1 級アルコールに対する第 2 級アルコール共存下の選択的酸化反応が報告された(Scheme 2)7)。
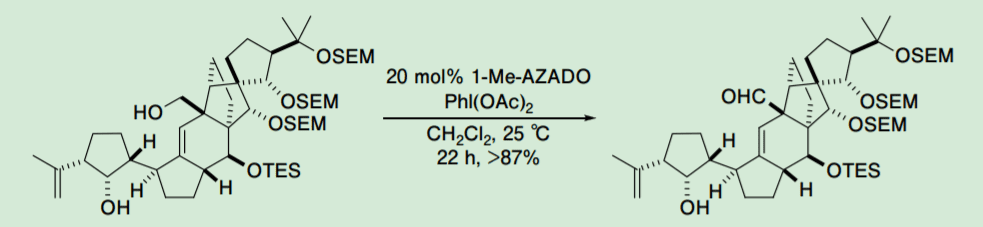
Scheme 2. Nicolaou's report on 1-Me-AZADO-catalyzed oxidation of the primary alcohol7)
しかしながら、1-Me-AZADO(3)は、この例のように第 2 級アルコールも混み合った位置にある場合には効率的な選択的酸化反応が進行する一方で、立体障害の大きなアルコールに対しても高い触媒活性を示すために第 1 級アルコール選択的酸化反応に対しては十分な基質一般性を持たない。
私たちは、この報告を受けネオペンチル位等の混み合った位置の第 1 級アルコールに対しても有効な"高活性"第 1 級アルコール選択的酸化触媒の開発の必要性を痛感した。
高活性第 1 級アルコール選択的酸化触媒:DMN-AZADO の触媒設計8)
高活性第 1 級アルコール選択的酸化触媒の開発にあたり、以前の AZADO 開発研究の過程で触媒構造と活性の関係を明らかとするために行った AZADO(2)、1-Me-AZADO(3)、1,5-Dimethyl-AZADO(5)の活性評価の結果に立ち返った(Table 1)3)。
Table 1. Catalytic activities of AZADO, 1-Me-AZADO, 1,5-Dimethyl-AZADO and TEMPO
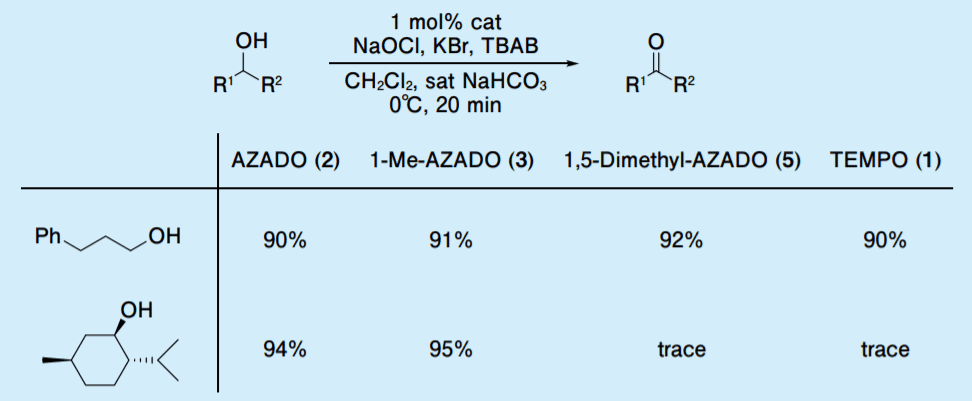
AZADO(2)と 1-Me-AZADO(3)は、第 1 級アルコールとかさ高い第 2 級アルコールのいずれのアルコールでも酸化が進行するのに対して、1,5-Dimethyl-AZADO(5)は、TEMPO(1)と同様ににかさ高い第 2 級アルコールの酸化はほとんど進行せず第 1 級アルコールの酸化のみが進行した。
この研究から、かさ高い第 2 級アルコールの酸化には、ニトロキシラジカル α 位に少なくとも 1 つ水素原子を持つことが重要であることがわかったが、当時、1,5-Dimethyl-AZADO(5)と TEMPO(1)との触媒活性の差についてはあまり注意を払っていなかった。
そこで改めて、TEMPO(1)と 1,5-Dimethyl-AZADO(5)の構造を比較した(Figure 2)。
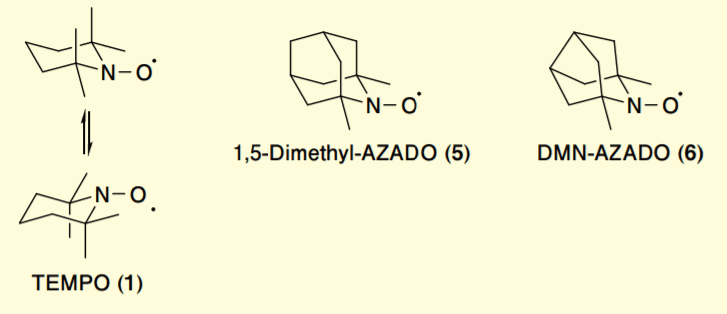
Figure 2. Structures of TEMPO, 1,5-Dimethyl-AZADO, and DMN-AZADO
TEMPO(1)と 1,5-Dimethyl-AZADO(5)は、いずれもニトロキシラジカル α 位に 2 つの四置換炭素を持ち、ニトロキシラジカル周辺の立体的環境は酷似している。しかし、TEMPO(1)はピペリジン環の反転を伴う分子振動によって α 位の 4 つのメチル基がより効果的に触媒活性部位を遮蔽している。
これに対して 1,5-Dimethyl-AZADO(5)は、かご状構造によってピペリン環の反転をおこさないリジッドな骨格を持つ。この分子振動による動的な分子構造の違いが、触媒活性に影響を与えるのではないかと考えた。さらに、Nor-AZADO(4)は、AZADO(2)に比べ 1 炭素分、環縮小した構造を持ち、これによってニトロキシラジカル部がより剥き出しになっているため、高い触媒活性を示すことがわかっている6)。
従って、Nor-AZADO(4)のニトロキシラジカル α 位に 2 つのメチル基を導入した 1,5-Dimethyl-Nor-AZADO(DMN-AZADO, 6)は、1,5-Dimethyl-AZADO(5)に比べより高い触媒活性が期待できる。このような考察によって、DMN-AZADO(6)の高活性第 1 級アルコール選択的酸化触媒としての高い可能性を見出すに至った。
DMN-AZADO(6)の触媒活性評価
グルタリルクロリドより容易に調製可能な 2,6-ヘプタンジオンと、アセトンジカルボン酸と酢酸アンモニウムの 3 成分縮合反応によって得られる 1,5-ジメチル-9-アザビシクロノナノンから収率よく DMN-AZADO(6)を合成する手法を確立し、触媒活性の評価を行った。
2,2,4-Trimethylpentane-1,3-diol(7)をモデル基質として、NaOCl を共酸化剤とする Anelli らの条件下に、TEMPO(1)、DMN-AZADO(6)、1-Me-AZADO(3)の触媒活性を比較した(Table 2)9)。
Table 2. Catalytic efficiencies of of TEMPO, DMN-AZADO, and 1-Me-AZADO for the selective oxidation of diol 7
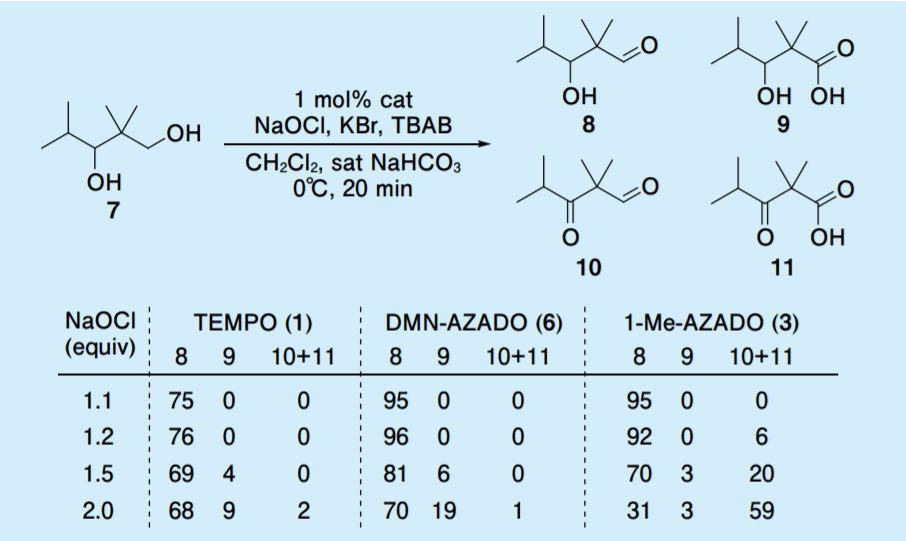
添加する NaOCl 量を 1.1 当量から徐々に増やしていくと、TEMPO は、目的のヒドロキシアルデヒド 8 の収率は 70% 台で頭打ちとなり、1-Me-AZADO(3)は、1.5 当量以上で 2 級アルコールが酸化された 10 および 11 の生成が顕著に増加した。これに対して、DMN-AZADO(6)は、安定して高収率で第 1 級アルコールか酸化された生成物が得られた。
この結果は、1-Me-AZADO(3)でも第 1 級アルコール選択的酸化反応が進行することを示しているが、その場合、厳密な当量制限が必要となる。しかしながら、次亜塩素酸ナトリウム水溶液の有効塩素濃度は変化しやすく一定に保つのが難しいため、厳密な当量制限を必要としない DMN-AZADO(6)は再現性よく目的の第 1 級アルコール選択的酸化反応を進行させるために有用であるものと考えている。
次に天然物合成への適用を想定したモデル基質としてベツリン(12)を選択し、PhI(OAc)2 を共酸化剤として第 1 級アルコール選択的酸化反応を検討した(Table 3)10)。
Table 3. Catalytic efficiencies of TEMPO, DMN-AZADO, and 1-Me-AZADO for the selective oxidation of betulin (12)
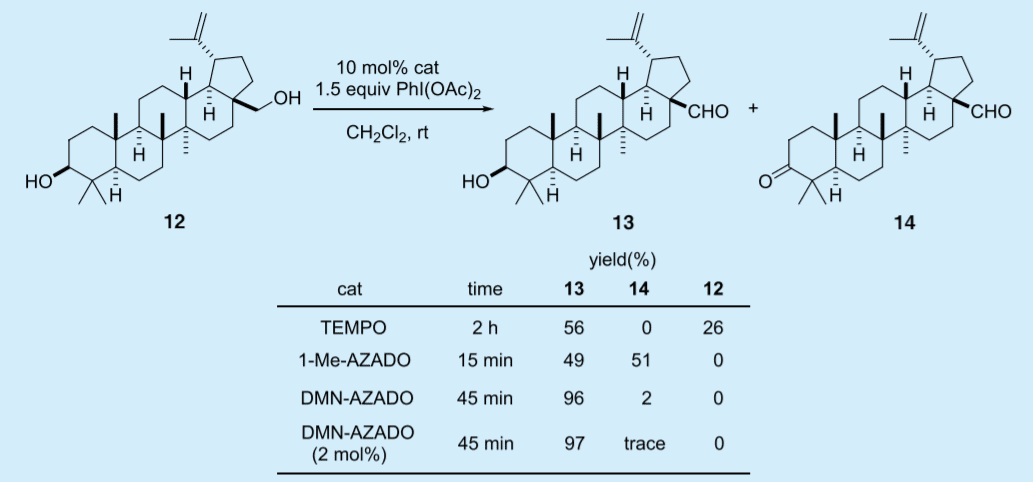
ベツリンの第 1 級アルコールはネオペンチル位に位置するために TEMPO(1)を触媒とした場合は、目的のヒドロキシアルデヒド 13 は中程度の収率であった。1-Me-AZADO(3)を触媒とした場合は、2 級アルコールの過剰酸化の抑制が難しく 13 の収率は中程度であった。これに対し、DMN-AZADO(6)を触媒とした場合は、高収率で目的生成物 13 を与えた。触媒量は、2 mol% まで減じても反応は効率的に進行した。
ジオールからヒドロキシカルボン酸への第 1 級アルコール選択的酸化反応
メルク社の Zhao らによって開発された TEMPO、NaOCl(触媒量)、NaClO2 を用いる酸化反応は、基質適用性に優れた手法として第 1 級アルコールからカルボン酸へのワンポット酸化反応に広く用いられている11)。従って、第 2 級アルコール共存下の第 1 級アルコールからカルボン酸への酸化反応も、同様の手法の適用が望ましい、
しかしながら、この手法は、第 2 級アルコール共存下に進行させようとした場合、極めて高い第 1 級アルコール選択性が要求される。それは、Scheme 3 に反応機構を示すようにアルデヒドの酸化によって触媒的に生成する NaOCl が触媒サイクル成立のために必須であることから、第 2 級アルコールの酸化が添加した NaOCl 量分進行すると反応は停止してしまうからである。
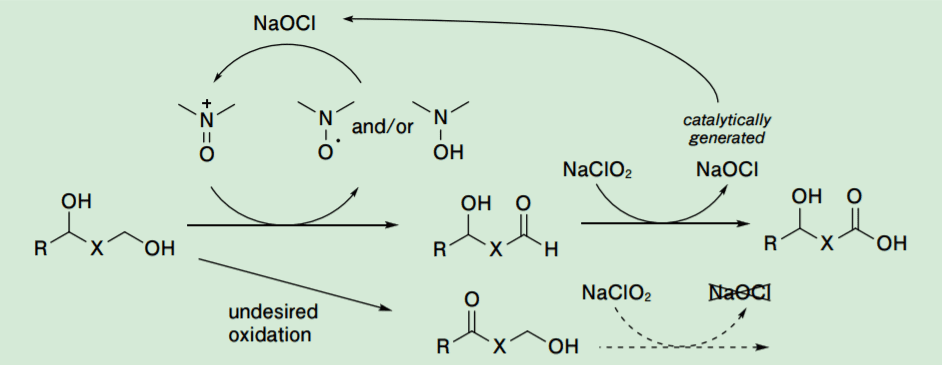
Scheme 3. Catalytic pathway of the nitroxy radical/NaCl/NaClO2 nethod
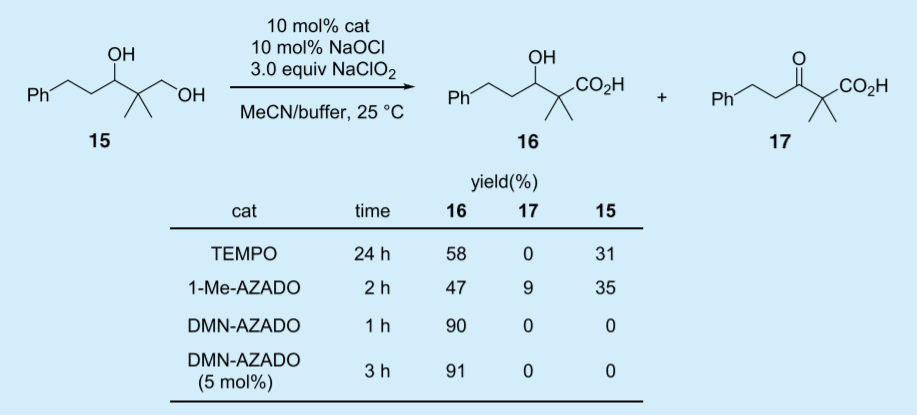
実際モデル基質 15 を用いた検討では、1-Me-AZADO(3)を触媒とすると第 2 級アルコールの酸化が進行し、反応が途中で停止してしまった(Talbe 4)。TEMPO(1)は、反応が遅く 24 時間後も中程度の収率であるのに対し、DMN-AZADO(6)は、短時間で反応が完結し高収率で目的生成物を与えた。
Table 4. Catalytic efficiencies of TEMPO, DMN-AZADO, and 1-Me-AZADO for the selective one-pot oxidation of diol 15
第 1 級アルコール選択的酸化反応による酸化的ラクトン化反応
TEMPO と PhI(OAc)2 を用いる条件下では、第 1 級アルコール選択的酸化反応によるジオールからの酸化的ラクトン化反応が進行することが Forsyth らによって報告されている12)。
最近、佐々木らによって、この酸化的ラクトン化反応は、中員環ラクトン合成にも有効であることも報告されている13)。そこで、DMN-AZADO(6)の酸化的ラクトン化反応に対する触媒活性についても評価した、その結果、収率は TEMPO(1)と同程度であるものの、反応時間は 3 分の 1 以下に短縮された(Scheme 4)。
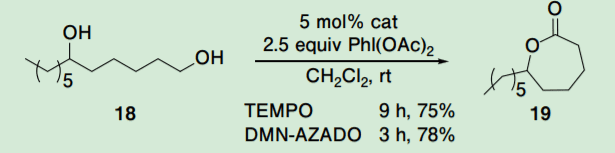
Scheme 4. Oxidative lactonization employing the selective oxidation
森らによる gymnocin-A 全合成への応用14)
ごく最近、森らによって強力な細胞毒性を有する海産ポリ環状エーテル gymnocin-A の全合成が達成され、その合成の最終段階に於いて DMN-AZADO(6)による第 1 級アルコール選択的酸化反応が適用された(Scheme 5)。すなわち、gymnocin-A の持つ 14 環性ポリ環状エーテルを構築した後に、第 1 級アルコールと 3 つの第 2 級アルコールを持つテトラオール 20 を基質としたトリヒドロキシアルデヒド 21 への極めてチャレンジングな第 1 級アルコール選択的酸化反応が DMN-AZADO(6)を用いて達成された。
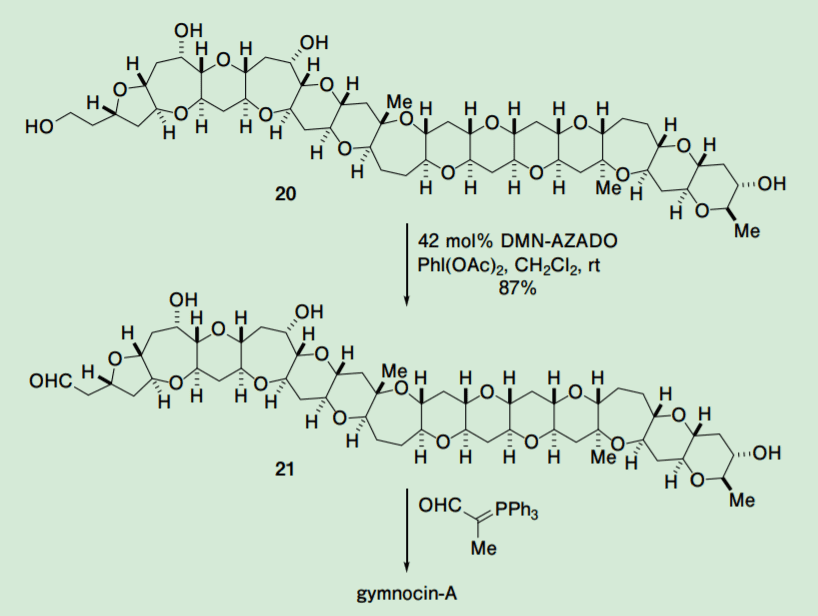
Scheme 5. Selective oxidation of the primary alcohol of tetraol (20) on the total synthesis of gymnocin-A
おわりに
DMN-AZADO(6)は、第 1 級アルコール選択的酸化反応をより強力な合成戦略とすると考えている。本触媒が、広く応用され無駄の無いより効率的な有機合成実現のための一助となることを願っている。本解説文では、紙面の都合上、基質一般性の詳細については省略したため、参考論文 8 を参照されたい。
参考文献
- Custar, D. W., Zabawa, T. P., Hines, J., Crews, C. M. and Scheidt, K. A. : J. Am. Chem. Soc., 131, 12406 (2009). DOI: 10.1021/ja904604x
- Vaswani, R. G. and Chamberlin, A. R. : J. Org. Chem., 73, 1661 (2008). DOI: 10.1021/jo702329z
- Shibuya, M., Tomizawa, M., Suzuki, I. and Iwabuchi, Y. : J. Am. Chem. Soc., 128, 8412 (2006). DOI: 10.1021/ja0620336
- Shibuya, M., Sasano, Y., Tomizawa, M., Hamada, T., Kozawa, M., Nagahama, N. and Iwabuchi, Y. : Synthesis. 21, 3418 (2011). DOI: 10.1055/s-0030-1260257
- Iwabuchi, Y. : Chem. Pharm. Bull., 61, 1197 (2013). DOI: 10.1248/cpb.c13-00456
- Hayashi, M., Sasano, Y., Nagasawa, S., Shibuya, M. and Iwabuchi, Y. : Chem. Pharm. Bull., 59, 1570 (2011). DOI: 10.1248/cpb.59.1570
- Nicolaou, K. C., Ortiz, A. and Zhang, H. : J. Angew. Chem. Int Ed., 48, 5648 (2009). DOI: 10.1002/anie.200902029
- Doi, R., Shibuya, M., Murayama, T., Yamamoto, Y. and Iwabuchi, Y. : J. Org. Chem., 80, 401 (2015). DOI: 10.1021/jo502426p
- Anelli, P. L., Biffi, C., Montanari, F. and Quici, S. : J. Org. Chem., 52, 2559 (1987). DOI: 10.1021/jo00388a038
- De Mico, A., Margarita, R., Parlanti, L., Vescovi, A. and Piancatelli, G. : J. Org. Chem., 62, 6974 (1997). DOI: 10.1021/jo971046m
- Zhao, M., Li, J., Mano, E., Song, Z., Tschaen, D. M., Grabowski, E. J. J. and Reider, P. J. : J. Org. Chem., 64, 2564 (1999). DOI: 10.1021/jo982143y
- Hansen, T. M., Florence, G. J., Lugo-Mas, P., Chen, J. H., Abrams, J. N. and Forsyth, C. J. : Tetrahedron Lett., 44, 57 (2003). DOI: 10.1016/S0040-4039(02)02489-9
- Ebine, M., Suga, Y., Fuwa, H. and Sasaki, M. : Org. Biomol. Chem., 8, 39 (2010). DOI: 10.1039/B919673K
- Sakai, T., Matsushita, S., Arakawa, S., Mori, K., Tanimoto, M., Tokumasu, A., Yoshida, T. and Mori, Y. : J. Am. Chem. Soc., 137 (45), 14513 (2015). DOI: 10.1021/jacs.5b10082




