【特別講座】N-ヘテロサイクリックカルベンの化学
本記事は、OrganicSquare Vol.48(2014年6月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

近年最も有機化学の世界を大きく変えつつある化合物群として、N-ヘテロサイクリックカルベン(NHC)類がある。遷移金属あるいは典型元素への配位子として、また有機触媒の一種として、NHCは多くの方面で活用され、化学の可能性を大きく押し広げたといえる。
2価の炭素であるカルベンという化学種は古くから知られていたが、あくまで不安定な反応中間体であり、単離は不可能とされてきた。しかし1960年代、Wanzlickはカルベン炭素が窒素などのヘテロ原子に挟まれていると、かなり安定に存在できるという予測を発表した1)。中心炭素の空の p 軌道へ、ヘテロ原子の孤立電子対から電子が流れ込み、安定化するためである。また環状の配座に固定されることで、安定化の度合いはより強められる。この様子は、下図のようにイリドとの共鳴構造として描くことができる。
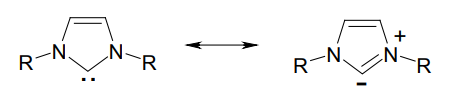
イリド構造との平衡
ただしこれでも、カルベンは空気中の酸素や水分と反応して分解するか、二量化して消失してゆく。1991年にArduengoらは、かさ高いアダマンチル基を2つの窒素原子に結合させ、立体的にカルベン炭素を保護することで、初めて結晶として単離可能な安定カルベンを創り出した2)。これは彼らの名を取り、Wanzlick-Arduengoカルベンと呼ばれる。
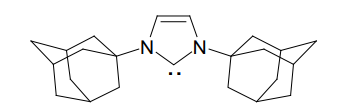
Arduengo らが合成した最初の安定カルベン
このタイプのカルベン合成法はいくつか知られているが、最もよく用いられるのは、グリオキサールとアミン、ホルムアルデヒドを酸性水溶液中で縮合させてイミダゾリウム塩とし、ここに強塩基を作用させてカルベンとするものである。
現在では、窒素以外のヘテロ元素を持ったものや、窒素がひとつだけのヘテロサイクリックカルベンなど、さまざまな類縁体も合成されている3)。しかし現在のところ、最も研究が進んでいるのはイミダゾリリデン型のNHCであり、本稿でもこの化合物の反応を中心に取り上げる。
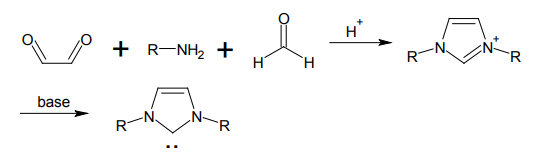
NHC 合成の一例
遷移金属への配位子として
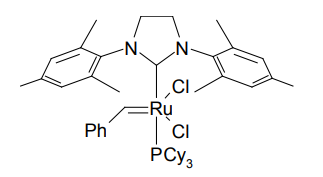
Grubbs 第二世代メタセシス触媒(Cy:シクロへキシル基)
NHCは2つの窒素原子からの電子供与があるため、ホスフィン類を上回る強力な配位子となりうる。特に遷移金属に対しては、事実上解離しないとみなしてよいほど、強く結合することが知られている。このNHC錯体を、有機金属触媒として用いる研究が、近年大幅に進展している。
触媒としてのNHC錯体の優れた点は、配位子から中心金属へ電子が流れこむことによってその活性を高めることが挙げられる。また、窒素上の置換基を変換することでかさ高さを調整し、性能をファインチューニングできる点も、実用上大きなメリットとなる。
配位子としてのNHCが最初に脚光を浴びるきっかけとなったのは、Grubbsらによってオレフィンメタセシス触媒の配位子として採用されたことであった。彼らが最初に世に送り出した、空気や湿気に対して安定なメタセシス触媒(いわゆる第1世代Grubbs触媒)は、トリシクロヘキシルホスフィン(Cy3P)を2つ配位子として用いたものであった。
1998年、GrubbsらはCy3Pの一方を、N-メシチル基を持ったNHCに置き換えた触媒を創製した4)。こうして合成された錯体は、オレフィンメタセシス触媒として極めて高い活性を示す上、安定性が向上していた。やがて、これは第2世代Grubbs触媒として広く用いられ、有機合成の考え方全体を、大きく変革することとなった。
Organ らの触媒
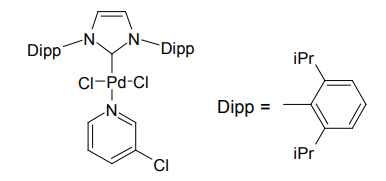
NHC配位子は、他にも多くの応用例がある。たとえばカナダのOrganらは、塩化パラジウム(II)にNHCと3-クロロピリジンを配位させた触媒を考案した5)。NHCはパラジウムの酸化的付加を促進し、3-クロロピリジンはすぐに解離する「使い捨て」配位子として働く。
この触媒は、熊田カップリング、根岸カップリング、鈴木-宮浦カップリング、Buchwald-Hartwigカップリングなど各種のクロスカップリング反応に利用可能で、既存の各種パラジウム触媒と同等以上の活性を示す。しかも、NHCの高い配位力を反映して極めて安定であり、水や空気の存在にほとんど影響を受けず、DMSO中120℃で数時間程度加熱してもほぼ分解を受けない。
この触媒において、NHC配位子はその電子供与性の高さによって酸化的付加を促進している。またそのかさ高さのため、還元的脱離が促され、触媒の効率を高めている。これにより、たとえば下図のようなカップリング反応が室温2時間ほどで終了し、高収率で付加体を与える。
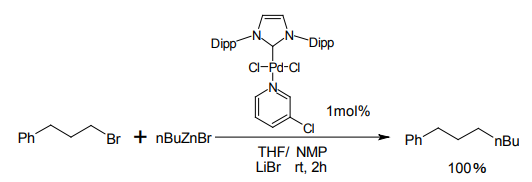
Organ らの触媒による根岸カップリング
その他にも、NHC錯体は各種触媒に用いられ、大きな成果を挙げている。また置換基を導入することで活性を高めたものなど、新たな配位子も登場している。
典型元素への配位子として
NHCは、典型元素の化学にも大きなインパクトを与えている。通常、安定には存在し得ない化学種が、カルベン電子対の配位により、安定に単離可能になるのだ。NHCはその高い電子供与能と、立体的なかさ高さによって不安定な結合を守っている。
これまで、さまざまな元素の「二原子分子」をNHCで挟む形にすることで、安定に単離することに成功している。たとえばRobinsonらは、NHCが配位した四塩化ケイ素をグラファイトカリウムで還元することにより、0価のケイ素-ケイ素二重結合化合物を得ることに成功している6)。これはケイ素の新たな同素体とみなすことができ、ケイ素化学の歴史において特筆される成果といえる。
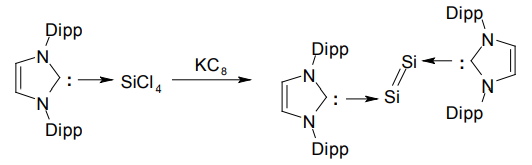
Robinson らによる 0 価ケイ素二重結合の合成
2012年には、Braunschweigらにより、ホウ素-ホウ素三重結合を持つ化合物・ジボリンの合成に成功したという報告がなされた7)。これも、ホウ素化学において長らく「夢の化合物」とされてきたものだ。テトラブロモジボランBr2B-BBr2にNHCを配位させ、ナトリウムナフタレニドで還元することで得られる。
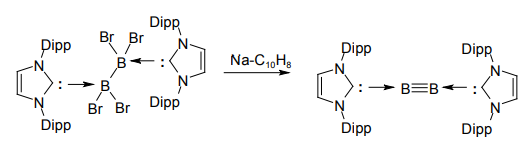
Braunschweig らによるジボリンの合成
このジボリンは、たとえば4分子の一酸化炭素と反応して、ビスラクトン型化合物を作るなどユニークな反応性を持つことがわかっている8)。NHCの化学が切り拓いた、豊かな可能性の一端といえる。
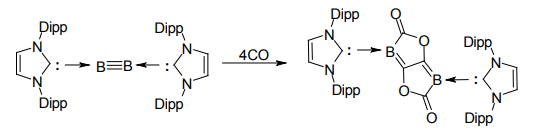
ジボリンの反応
その他、たとえばリンやゲルマニウムの2原子分子9)、0価の単原子ケイ素(シラジカルベン)なども、NHCでサンドイッチすることで単離に成功している10)。今後も、配位子や合成方法にさらに工夫が凝らされ、今までにない化学種が続々と登場してくることであろう。
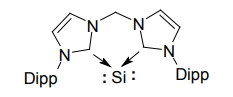
Driess らによるシラジカルベン
有機触媒としてのNHC
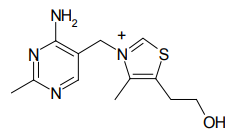
チアミン
NHCはこうした配位子としての利用だけでなく、単独で有機触媒としても働き、これも極めて広い可能性を持っている。このジャンルが注目を浴びたのはWanzlick-Arduengoカルベンの登場以降だが、ルーツを探っていくと一世紀以上も遡ることができ、ここには日本人が大いに貢献している。
1910年、鈴木梅太郎がチアミン(ビタミンB1)を発見したのが、NHC触媒の化学の始まりといえる。1943年には、チアミンがベンゾイン縮合反応を触媒することを鵜飼貞二らが報告し、1957年 R. Breslowによってその反応機構が解明された11)。
反応機構を以下に示す。チアミンに塩基が作用して発生するNHCが活性種となる。これがアルデヒドのカルボニル炭素に対して求核攻撃し、プロトンの移動を経てアシルアニオン等価体が生成、ここにもう一分子のアルデヒドが結合、NHCが解離してゆくというサイクルによる。つまりアルデヒドは、NHCの働きによって極性逆転を起こし、2分子が結びついている。
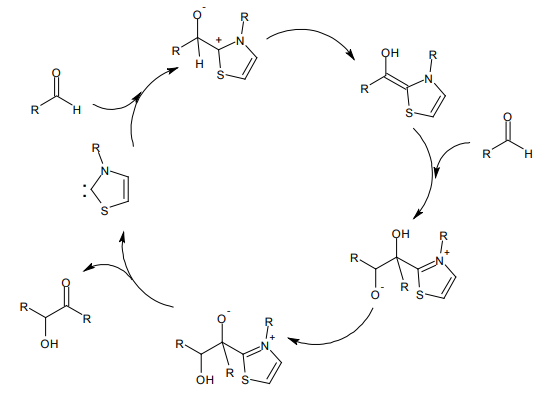
チアミンによるベンゾイン縮合のサイクル
1980年代には、宮下晶らがイミダゾリウム由来のカルベンを用いて、求核的アシル化というユニークな反応を報告している12)。まだWanzlick-Arduengoカルベンや、有機触媒という概念が登場するはるか以前のことであり、この分野のパイオニア的研究といえよう。
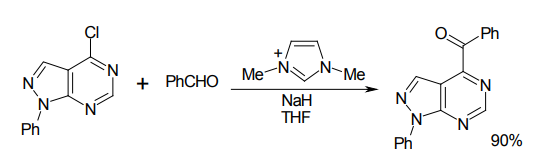
宮下らによる求核的アシル化反応
アルデヒドとカルベン触媒から生成するアシルアニオン等価体は、他にも多くの求電子剤と反応する。電子不足アルケンに対しての1,4-付加はStetter反応と呼ばれ、分子内で環形成にも用いられる。
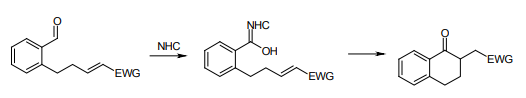
分子内 Stetter 反応(EWG は電子求引基)
この他、BodeやGloriusらにより、多くの反応が開発されており、応用範囲は幅広い。詳細は、参考文献に挙げた総説を参照されたい13)。
NHCに分子設計を施すことにより、不斉ベンゾイン縮合・不斉Stetter反応を行う試みもなされ、1995年ごろからトリアゾリウム系触媒に不斉要素を組み込んだものが登場してきた。中でもRovisらによって開発された四環性触媒(Rovis触媒)は、ベンゾイン縮合・分子内Stetter反応などで優れた成果を挙げており、広く用いられている14)。
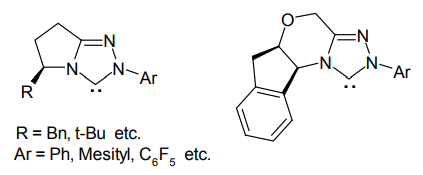
不斉 NHC 触媒の例
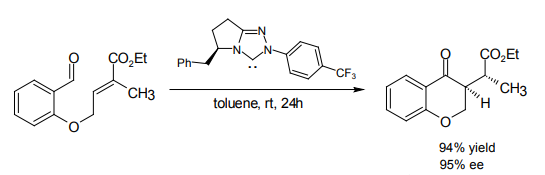
Rovis 触媒による分子内 Stetter 反応
またNHCの高い求核性を活かし、二酸化炭素の活性化を行う例も登場した。たとえばNHC触媒のもと、ジフェニルシランを還元剤とし、二酸化炭素をメタノールにまで還元する反応が、シンガポールのY. Zhang, J. Y. Yingらから報告されている15)。これまでにも金属触媒を用いた同様の反応は存在したが、これらは酸素に弱いという大きな弱点があった。NHCは酸素の存在下でも全く問題なく反応が進行し、大気中の二酸化炭素からさえメタノールを生成することが可能とされる。
また、二酸化炭素を酸化剤として、アルデヒドをカルボン酸へ変換する反応も、同じグループから報告されている16)。逆に言えば、アルデヒドを還元剤として、豊富に入手できる二酸化炭素を、合成原料として有用な一酸化炭素に変換できるということにもなる。二酸化炭素の資源化は、現代の化学に課せられた重要なテーマのひとつだが、NHCの特異な反応性はその重要な糸口となりそうだ。
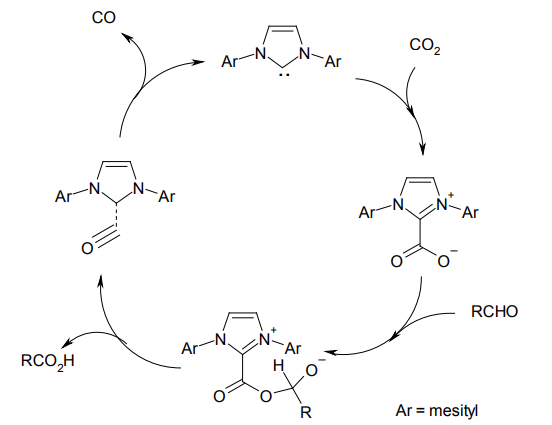
NHC 触媒による二酸化炭素の活性化機構
このように、NHCは各方面で広く用いられ、今までになかった独特の分野を切り拓いている。カルベンという特異な化学種であるだけに、新たな工夫の余地は広く、まだまだ新規な応用が出てくるであろう。今後のこの分野の進展を、興味深く見守りたい。
参考文献
- Wanzlick, H. W., Schikora, E. : Angew. Chem., 72, 494 (1960).
- Arduengo, A. J. et al. : J. Am. Chem. Soc., 113, 361 (1991). DOI: 10.1021/ja00001a054
- Melaimi, M. et al. : Angew. Chem. Int. Ed., 49, 8810 (2010). DOI: 10.1002/anie.201000165
- Weskamp T. et al. : Angew. Chem. Int. Ed., 37, 2490 (1998). DOI: 10.1002/(SICI)1521-3773(19981002)37:18<2490::AID-ANIE2490>3.0.CO;2-X
- Hadei, N. et al. : Org. Lett., 7, 3805 (2005). DOI: 10.1021/ol0514909
- Wang Y. et al. : Science, 321, 1069 (2008). DOI: 10.1126/science.1160768
- Braunschweig, H. et al. : Science, 336, 1420 (2012). DOI: 10.1126/science.1221138
- Braunschweig, H. et al. : Nature Chem., 5, 1025 (2013). DOI: 10.1038/nchem.1778
- Wang, Y., Robinson, G. H. : Inorg. Chem., 50, 12326 (2011). DOI: 10.1021/ic200675u; Wang, Y., Robinson, G. H. : Dalton Trans., 41, 337 (2012). DOI: 10.1039/C1DT11165E
- Xiong, Y. et al. : Angew. Chem. Int. Ed., 52, 7147 (2013). DOI: 10.1002/anie.201302537
- Breslow, R. : J. Am. Chem. Soc., 80, 3719 (1958). DOI: 10.1021/ja01547a064
- Higashino, T. et al. : Bull. Chem. Soc. Jpn., 33, 1399 (1985).
- Marion, M. et al. : Angew. Chem. Int. Ed., 46, 2988 (2007). DOI: 10.1002/anie.200603380; Enders, D. et al. :Chem. Rev., 107, 5606 (2007). DOI: 10.1021/cr068372z
- Read de Alaniz, J. et al. : J. Org. Chem., 73, 2033 (2008). DOI: 10.1021/jo702313f
- Riduan, S. N. et al. :Angew. Chem. Int. Ed., 48, 3322 (2009). DOI: 10.1002/anie.200806058
- Gu, L., Zhang, Y. :J. Am. Chem. Soc., 132, 914 (2010). DOI: 10.1021/ja909038t




