キャピラリー電気泳動の基礎知識
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。
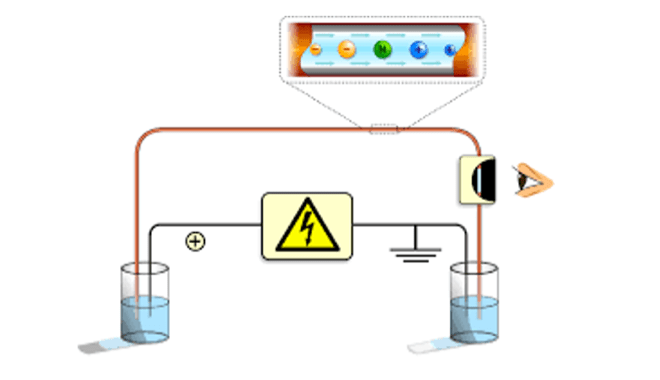
概要
機器分析手法の一つ、キャピラリー電気泳動 (Capillary Electrophoresis) の基礎知識について紹介します。有機系の研究室ではあまりなじみのない分析手法かもしれませんが、主に微量のイオン性試料を精密に定性・定量する際に強力なツールです。また、測定対象が非イオン性の中性分子であっても試料調製によって測定でき、幅広い試料の測定が可能となっています。
原理と測定対象
生化学系の分野で行われるアクリルアミドゲル電気泳動が好例ですが、そもそも電気泳動とは、高電圧 (数十kV) を印加した際に、溶液中のイオンがクーロン力に基づいて、陽イオンは陰極側へ、陰イオンは陽極側へと移動 (泳動) する現象を指します。一般に泳動速度Vepは試料分子の電荷qと分子半径rに依存し、電場をE、溶液の粘度をηとして以下のように表されます。
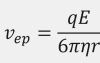
キャピラリー電気泳動の最大の特徴は細い (内径:数十μm) シリカのキャピラリー内に泳動液を満たして試料の泳動を行う点です。シリカキャピラリーの内壁にはシラノール基 (-SiOH) が無数に存在しており、強酸性溶液中を除くとプロトンを解離して-SiO-となり、電気二重層を形成します。そのため、高電圧を印加することで内壁近傍の過剰の正電荷が周囲の水分子を引き連れて陰極側へと流れます。こうして生じる溶液の流れを電気浸透流 (Electroosmotic Flow;EOF) と呼びます。なお、シリカ以外にもパイレックスガラスやテフロンのキャピラリーも存在しますが、同様の現象が起こります。
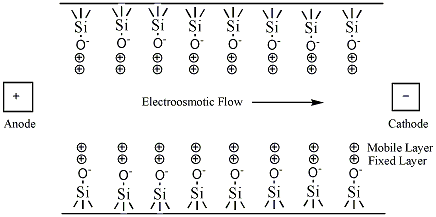
電気浸透流の原理 (画像:Wikipedia)
電気浸透流は試料イオンの泳動速度より速いため、測定対象が陰イオンであっても陰極側へと流れます。その結果、陰極方向への泳動順は陽イオン、中性分子、陰イオンの順となります。泳動結果はキャピラリーを光学的に測定して、クロマトグラムに似たグラフ (電気泳動図、エレクトロフェログラム) として得られます。

泳動される順序の概略 (画像:Wikipedia)
発展の歴史
電気泳動の歴史は1886年にLodgeがフェノールフタレインをゲル電気泳動したことに遡ります。プロトンの泳動により指示薬の色調変化が起こるものでした。その後、U字管を用いたヘモグロビンやコロイド粒子などの泳動実験から巨大分子への適用が進み、アクリルアミドゲル電気泳動や等電点電気泳動へと発展しました。
細管中の自由溶液を用いるキャピラリー電気泳動の先駆としては、Everaertsらによる高分離能でのカルボン酸の分離研究が挙げられます。キャピラリー電気泳動では極めて細い管を用いるため分離精度を向上させやすく、光学的なオンキャピラリー検出による高い再現性も利点となり、1960年代以降急速に普及しました。
電荷とサイズの相違を用いて分離を行うキャピラリー電気泳動でしたが、1984年にTerabeらがイオン性界面活性剤を添加した泳動液を用いたミセルを形成させ、中性分子の分離を可能にしたことで、さらに広範な試料の分析が可能となりました。さらに光学異性体の分離、マイクロチップ電気泳動法による超微量分析も可能です。操作面では測定の自動化も進展しています。
他の機器分析法との比較
キャピラリー電気泳動は、溶液試料を移動度の差で分離するという点で液体クロマトグラフィー (LC) に類似しています。しかし、微量資料の分析が可能なほか、分離能においても一般にキャピラリー電気泳動の方が優れています。その背景には、先述した電気浸透流の特異性があります。
電気浸透流の特徴は、ほぼ均一な流速分布を有する栓流です。液体クロマトグラフィーのように細管に圧力をかけることで液体を流す圧力流 (層流) がパラボラ型の流速分布を有するのと対照的です。これにより、キャピラリー電気泳動では液体クロマトグラフィーと比較してピーク広がりが生じにくく、鋭いピークが得られやすくなっています。
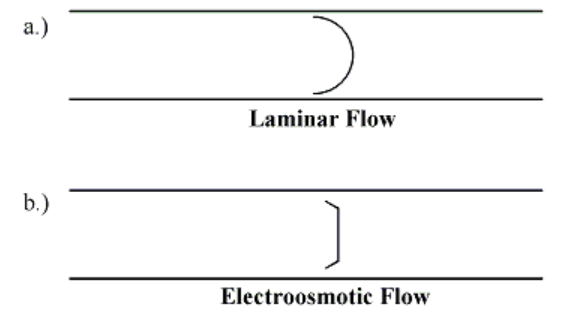
電気浸透流(b)と圧力流(a)の比較 (画像:Wikipedia)
キャピラリー電気泳動の欠点は、疎水性試料の分析に不向きな点、分取が困難な点です。他の電気泳動法と比較すると、キャピラリー電気泳動は優れた点多いです。ゲル電気泳動においては支持体の調製における再現性がネックとなることが多く、微量分析であればキャピラリー電気泳動が有効です。また、膜やゲル由来の吸収の不均一性が課題となる一方で、キャピラリー電気泳動は均一な溶液を用いることから定量性に優れます。
注意点とTips
分離が悪い場合、泳動液のpHを変更することで改善される場合があります。例えば酸解離定数の異なる有機酸を分離する場合、一方が解離しやすく他方が解離しにくいpHを選択すると泳動速度に差をつけることができます。アミノ酸などの等電点を持つ試料も同様です。
- カチオンの泳動速度が速すぎて分離困難な場合には、電気浸透流を低減させる必要があります。これは泳動液のpHを4以下にしてシラノール基の解離を抑制すれば可能です。
- 疎水性の高い試料の場合には、泳動液中にメタノールやアセトニトリルなどの有機溶媒を添加して溶解状態を保ちます。析出による再現性低下を防ぐ目的です。
- 電気浸透流の流速をモニタリングすると、試料の電荷やサイズなどの情報が得られます。この目的でチオ尿素などの中性分子が内部標準として添加されることがあります。
装置構成と測定方法
キャピラリー電気泳動装置の中核となるのは①泳動場となるキャピラリー、②泳動液、③両極の溶液を保持するリザーバー、④高圧電源と電極、⑤検出器の5点です。
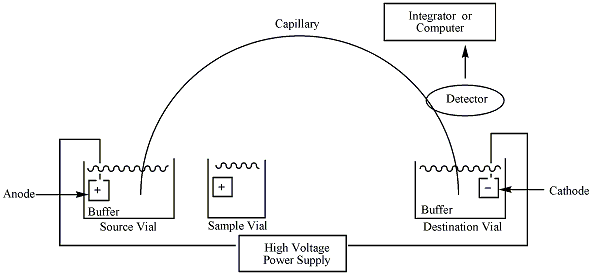
キャピラリー電気泳動装置の概要 (画像:Wikipedia)
①キャピラリー
内径数十μmオーダーのシリカキャピラリーを用いるのが一般的です。脆く折れやすいなど取り扱いに難があることから、表面にポリイミド樹脂で被覆した状態で市販されています。
②泳動液
電気泳動の間、電気分解によるpH変動に耐える必要があることから各種緩衝液がベースとして選択されます。ミセル形成のための界面活性剤や、その他にも溶解性確保のための有機溶媒や添加剤が加えられることもあります。
③リザーバー
一般にはバイアルが用いられます。これを通じて試料導入や電圧印加が行われます。
④高圧電源と電極
電気泳動には数百V/cmオーダーの強電場が必要となり、さらに十分な分離のためには数十cmのキャピラリーが必要となることから、数十kV近い高圧電源が必要となります。電極材料には耐食性に優れ化学変化を受けにくい白金が好まれます。
⑤検出器
キャピラリーごと紫外可視吸収分析 (UV-Vis) を行うことが一般的です。光源には重水素ランプのほか、高感度の装置ではレーザー光が選択される場合も増えています。多くの試料分子・イオンは特異的な吸光を示さないことから、泳動液中にマーカーとなる色素や蛍光物質を添加し、試料通過時のみシグナルが低下することを利用した間接UV法もあります。
ほかにも屈折率を用いる検出法や、円二色性検出法、電気化学的に検出する方法のほか、質量分析に結合して感度を高めた手法 (CE-MS) などがあります。
また、試料導入法として代表的なものに落差法、吸引法、加圧法と、電気的に導入する手法があります。落差法は、キャピラリーの一端を試料溶液につけて持ち上げて試料を管内に導入する方法です。微量試料 (nLオーダー) を再現よく導入できることから汎用されています。
応用編
生体分子の分析
比較的高いpH領域でキャピラリー内壁への吸着を防ぎつつ、等電点などを利用してタンパク質・ペプチド・アミノ酸を分離分析する手法が古くから知られています。このほか、キャピラリー電気泳動の高い分離能を活かしたDNAなどの核酸関連物質の分離も可能となっています。
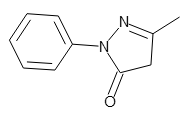
中性分子である糖質の分離においては、誘導体化によるイオン性物質への変換が広く用いられています。具体的にはホウ酸錯体の形成や、1-フェニル-3-メチルピラゾロン (PMP:以下の構造) によるアダクト形成などが挙げられます。
光学分割
Gastmannらは1985年、Cu(II)のL-ヒスチジン錯体を泳動液に添加することで種々のアミノ酸の光学分割に成功しました。このほかにもクラウンエーテルやシクロデキストリン (CD) の包接作用を利用して光学分割を行う手法が知られています。




