COA-Cl
COA-Cl
|
比較
|
製品コード
|
容量
|
価格
|
在庫 / 納期目安
|
|
|---|---|---|---|---|---|
|
|
|
1mg
|
|
販売終了
|
|
|
|
|
5mg
|
|
照会 |
|
|
|
|
25mg
|
|
照会 |
ドキュメント
概要
COA-Cl(コアクロル)は、血管新生促進作用を示す低分子化合物です。神経保護・栄養作用も示します。水溶性の低分子化合物であり、VEGFやNGFに代わり再生医療における血管や神経の構築に用いることができる可能性があります。また、Xeno-free培地の添加剤として有用である可能性があります。
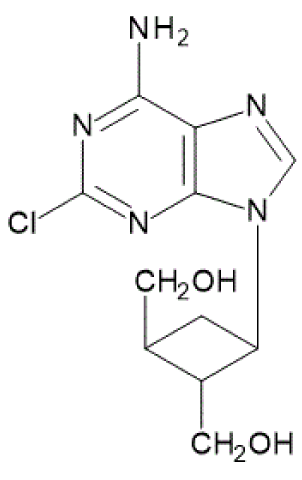
- C11H14ClN5O2=283.71
CAS RN® 1253579-96-2
データ
血管内皮細胞と線維芽細胞の共培養系での使用例:血管新生促進作用

10日間培養後に形成される管腔面積が増加した。
(データご提供:香川大学医学部 塚本郁子先生)
ニワトリ漿尿膜(CAM)とウサギ角膜を用いた血管新生促進作用確認例
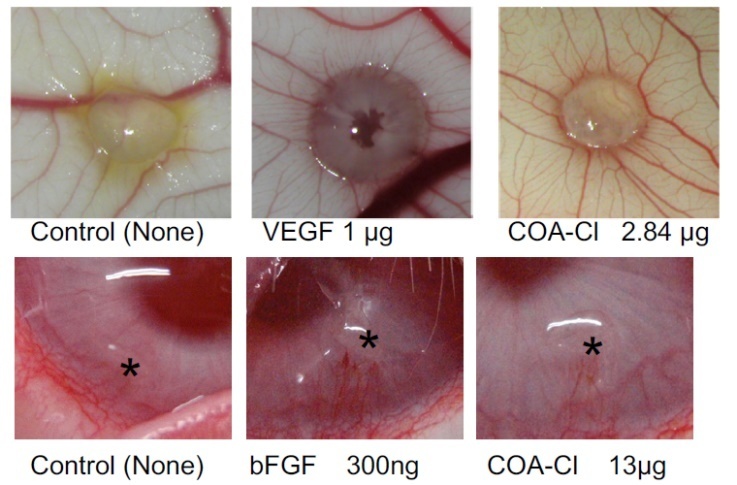
(データご提供:香川大学医学部 塚本郁子先生)
正常ヒト線維芽細胞におけるVEGF産生分泌促進作用確認例
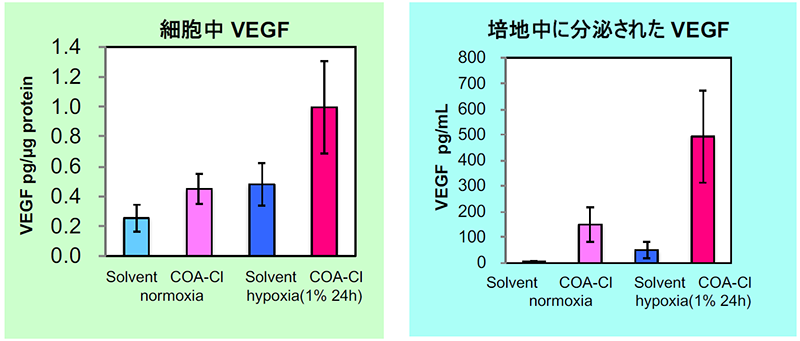
±COA-Cl(100mmol/L)の培地に交換し、24時間後、±低酸素(1%)に24時間おき、細胞中、培地中のVEGFをELISAで定量した。
COA-Clを含む培地で培養した場合、より高いVEGF産生・分泌が確認された。
(データご提供:香川大学医学部 塚本郁子先生)
神経モデル細胞(PC12 )における突起伸長(96時間後):神経栄養作用
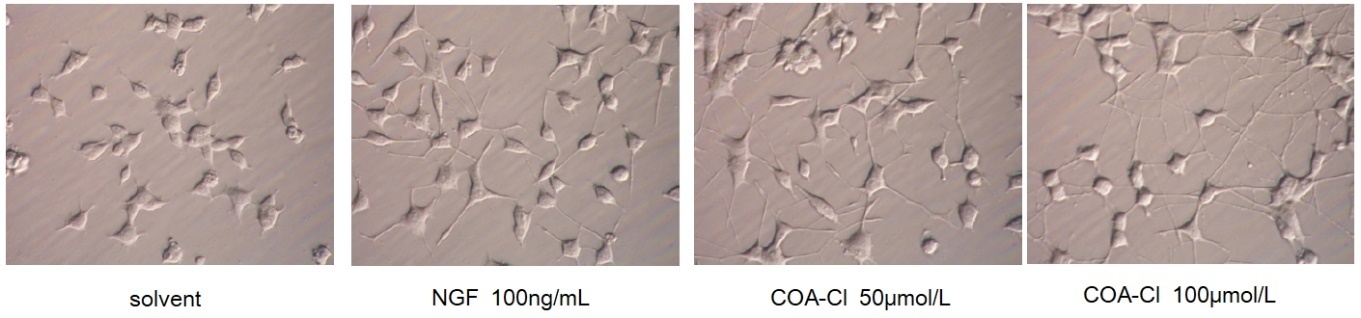
(データご提供:香川大学医学部 塚本郁子先生)
神経モデル細胞(PC12 )におけるドパミン濃度の上昇
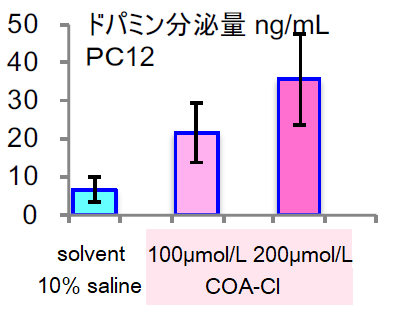
培養3日後の培地中ドパミン濃度をHPLCで測定した。
ドパミン濃度の上昇が確認された。
(データご提供:香川大学医学部 塚本郁子先生)
ラットグリオーマ細胞(C6)の培養例:細胞保護作用

- (A) DーMEM
(B) DーMEM+血清(ウマ15%+ウシ2.5%)
(C) DーMEM+COA-Cl(100μmol/L)
ラットグリオーマ細胞(C6)を24ウェルプレートに播種し、翌日、(A)、(B)、(C)に置換し、16日間培養した(培地交換なし)。
(A)、(B)では、12日目に細胞が死滅したが、(C)では12日目も変化なく、さらに14日目に培地を(B)に交換すると、増殖を始めた。
(データご提供:香川大学医学部 塚本郁子先生)
神経モデル細胞(PC12)の培養例:代替血清としての可能性
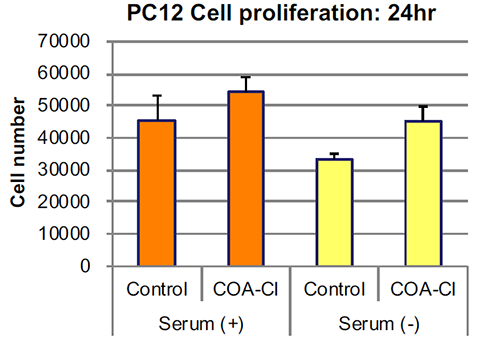
神経モデル細胞(PC12)を播種し、翌日、DーMEM±血清(ウマ10%+ウシ5%)に交換してCOA-Cl(100μmol/L)を添加、24時間後に細胞数を計測した。
COA-Clを添加した場合、細胞数の増加が確認できた。また、血清を含まない培地においても、COA-Clを添加した培地では、血清を添加した培地と同様の細胞増殖を示した。
(データご提供:香川大学医学部 塚本郁子先生)
神経モデル細胞(PC12)の培養例:酸化ストレスからの保護作用
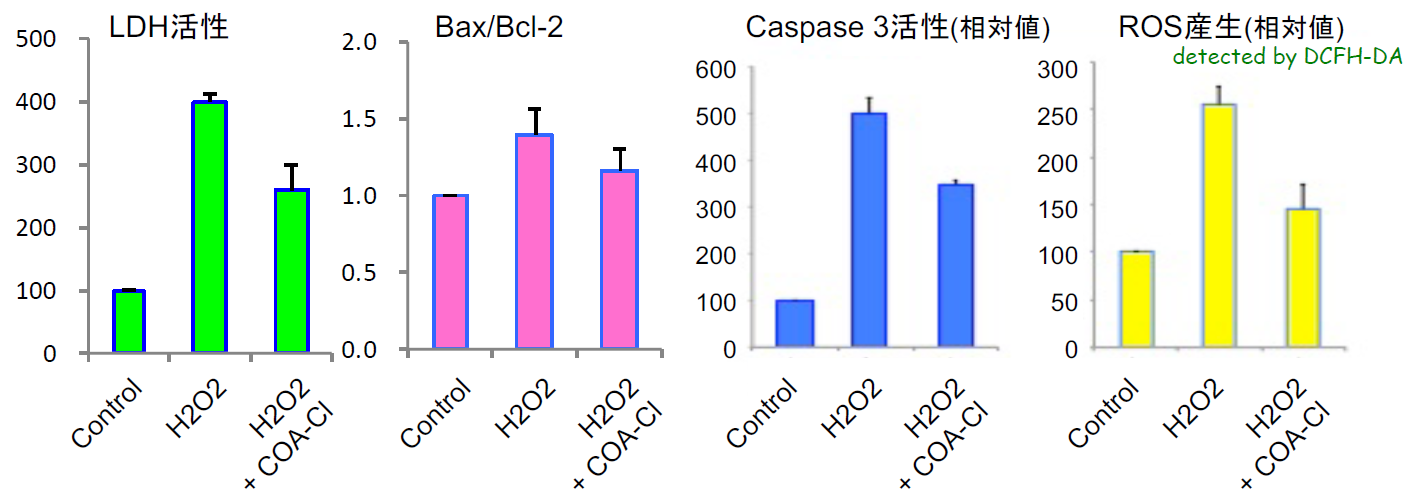
神経モデル細胞(PC12)を播種し、翌日培地交換してCOA-Cl(100μmol/L)、過酸化水素(200μmol/L)を添加、24時間後にストレスに応じて放出されるLDH、アポトーシス関連タンパク質、活性酸素を測定した。
COA-Clを添加した場合は、LDH、アポトーシス関連タンパク質、活性酸素の放出量が減少した。
(データご提供:香川大学医学部 塚本郁子先生)
参考文献
- Tsukamoto, I., Sakakibara, N., Maruyama, T., Igarashi, J., Kosaka, H., Kubota, Y., Tokuda, M., Ashino, H., Hattori, K., Tanaka, S., Kawata, M. and Konishi, R. : Biochem. Biophys. Res. Commun. 399, 699 (2010).
血管内皮細胞(HUVEC)におけるCOA-Clの作用点は、VEGF受容体よりも下流で、MAP kinase cascadeのMEK、ERK1/2を活性化させる。 - Igarashi, J., Hashimoto, T., Kubota, Y., Shoji, K., Maruyama, T., Sakakibara, N., Takuwa, Y., Ujihara, Y., Katanosaka, Y., Mohri, S., Naruse, K., Yamashita, T., Okamoto, R., Hirano, K., Kosaka, H., Takata, M., Konishi, R. and Tsukamoto, I. : Pharmacol. Res. Perspect., 2(5), e00068 (2014).
S1P1受容体やカルシウムイオンの関与。 - Igarashi, J., Okamoto, R., Yamashita, T., Hashimoto, T., Karita, S., Nakai, K., Kubota, Y., Takata, M., Yamaguchi, F., Tokuda, M., Sakakibara, N., Tsukamoto, I., Konishi, R. and Hirano, K. : Physiol. Rep., 4, e12742 (2016).
VEGFの遺伝子レベル(mRNA)の上昇を確認。HIF1αではなく転写補助因子PGC1αが寄与している。 - Okabe, N., Nakamura, E., Himi, N., Narita, K., Tsukamoto, I., Maruyama, T., Sakakibara, N., Nakamura, T., Itano, T. and Miyamoto, O. : Brain Res., 1506, 115 (2013).
ラット脳梗塞モデルにおいて、損傷体積を減少させ、clinical scoreを改善する。 - Kishimoto, Y., Tsukamoto, I., Nishigawa, A., Nishimoto, A., Kirino, Y., Kato, Y., Konishi, R., Maruyama, T. and Sakakibara, N. : Data Brief, 20, 1877 (2018).
アルツハイマーモデルマウスの記憶学習を改善する。 - Jamal, M., Tsukamoto, I., Takata, M., Ito, A., Tanaka, N., Miki, T., Takakura, A., Ameno, K., Kubota, Y., Konishi, R. and Kinoshita, H. : Brain Res., 1706, 68 (2019).
神経モデル細胞(PC12)、マウス脳内におけるドパミン濃度を上昇する。 - Lu, F., Nakamura, T., Okabe, N., Himi, N., Nakamura-Maruyama, E., Shiromoto, T., Narita, K., Tsukamoto, I., Xi, G., Keep, R. F. and Miyamoto, O. : J. Stroke Cerebrovasc. Dis., 25, 2637 (2016).
ラット脳出血モデルにおける症状の改善。 - Nishikido, T., Oyama, J., Shiraki, A., Tsukamoto, I., Igarashi, J. and Node, K. : Sci. Rep., 9, 2533 (2019).
マウス心筋梗塞モデルにおける症状の改善。 - Kawami, M., Deguchi, J., Yumoto, R., Sakakibara, N., Tsukamoto, I., Konishi, R. and Takano, M. : Drug Metab. Pharmacokinet., 32, 224 (2017).
TGFβ誘発性の肺の線維化抑制。 - Nakai, K., Karita, S., Igarashi, J., Tsukamoto, I., Hirano, K. and Kubota, Y. : J. Dermatol. Sci., 94, 205 (2019).
TGFβ誘発性の皮膚の線維化抑制。
概要・使用例
| 概要 | COA-Cl(コアクロル)は、血管新生促進作用を示す低分子化合物です。神経保護・栄養作用も示します。水溶性の低分子化合物であり、VEGFやNGFに代わり再生医療における血管や神経の構築に用いることができる可能性があります。また、Xeno-free培地の添加剤として有用である可能性があります。 本品は血管新生促進作用を持つ低分子量化合物です。 ヒト臍帯静脈内皮細胞(HUVEC)を用いた培養細胞を用いた検証においては管腔形成促進作用を。ニワトリ漿尿膜及びウサギ角膜を用いた検証においても血管新生の促進作用を確認しています。 特長 ●血管新生促進作用が見出された低分子化合物 HUVEC(ヒト臍帯静脈内皮細胞)における管腔形成促進。CAMアッセイ(ニワトリ漿尿膜)、ウサギ角膜における血管新生促進 ●HUVECにおいてVEGFR-2の活性化は起こさないが、MEK(MAPKK)、ERK1/2(MAPK)の活性化(りん酸化)を促進 和光純薬時報 Vol.78 No.4 p.13 (2010.10) 本品は血管新生促進能を持つ低分子量化合物です。血管新生に関与する因子にはVEGF(血管内皮細胞成長因子)、PDGF(血小板由来成長因子)、HGF(肝細胞増殖因子)、FGF(線維芽細胞成長因子)、アンギオポエチン等、さまざまなものが知られていますが、これらはいずれも高分子ペプチドであり、安定な低分子でその作用を持つものは知られておりません。 血管新生ががんの成長や転移に必須であることから、血管新生抑制剤を抗がん剤として用いるための研究開発が盛んですが、糖尿病や動脈硬化による血管閉塞等に起因する血流不足に対しては血管新生促進剤の開発も期待されています。 【特長】 ●血管新生促進作用が見出された低分子量化合物[HUVEC(ヒト臍帯静脈内皮細胞)における管腔形成促進/CAM(ニワトリ漿尿膜)、ウサギ角膜における血管新生促進] ●HUVECにおいてVEGFR-2の活性化は起こさないが、MEK(MAPKK)、ERK1/2(MAPK)の活性化(りん酸化)を促進 Wako Bio Window No.105, p.11 (2010.10) |
|---|---|
| 用途 | 血管モデル作製 疾病モデル作製 薬剤作用機序などの解析 細胞活性化 など |
| 使用例 | Stock Solutionの調製:生理食塩水で2mMに溶解 使用濃度:HUVECに対しては 10~500μM 保存条件:室温 (溶解後、冷蔵にて保存) |
物性情報
| 外観 | 白色〜わずかにうすい褐色、結晶性粉末〜粉末又は塊 |
|---|---|
| 溶解性 | 水に溶ける。「溶解性情報」は、最適溶媒が記載されていない場合がございます。 |
「物性情報」は参考情報でございます。規格値を除き、この製品の性能を保証するものではございません。
本製品の品質及び性能については、本品の製品規格書をご確認ください。
なお目的のご研究に対しましては、予備検討を行う事をお勧めします。
製造元情報
別名一覧
- 2-Cl-C.OXT-A
2-クロロ-9-[2α,3β-ビス(ヒドロキシメチル)シクロブチル]-9H-プリン-6-アミン
コアクロル
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 製品規格・包装規格の改訂が行われた場合、画像と実際の製品の仕様が異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。








