アイソスピン プラント RNA
ISOSPIN Plant RNA
- 製造元 :
- (株)ニッポンジーン
- 保存条件 :
- 冷凍 (ドライアイス輸送)
- 適用法令 :
- 安衛法57条・有害物表示対象物質 労57-2 危4-ア(水溶性)-II
- GHS :
-
- 構造式
- ラベル
- 荷姿
|
比較
|
製品コード
|
容量
|
価格
|
在庫 / 納期目安
|
|
|---|---|---|---|---|---|
|
|
|
50回用
|
|
照会 |
|
|
|
|
200回用(50回用×4)
|
|
照会 |
|
ドキュメント
- 添付文書
-
- スペクトルデータ
-
- 検査成績書
-
- 校正証明書
-
- 分析チャート
-
キットコンポーネント
50回用
| PT Extraction Buffer | 30 ml×1 本 |
|---|---|
| PT Binding Buffer | 40 ml×1 本 |
| PT Wash1 Buffer | 40 ml×1 本 |
| PT Wash2 Buffer | 40 ml×1 本 |
| DNase I (RNase free) | 2,000 units×1 本 |
| 10×DNase I Buffer | 1 ml×1 本 |
| ddWater (RNase free) | 1 ml×8 本 |
| Spin Column | 50 本×1 袋 |
200回用
| PT Extraction Buffer | 30 ml×4本 |
|---|---|
| PT Binding Buffer | 40 ml×4本 |
| PT Wash1 Buffer | 40 ml×4本 |
| PT Wash2 Buffer | 40 ml×4本 |
| DNase I (RNase free) | 2,000 units×4 本 |
| 10×DNase I Buffer | 1 ml×4 本 |
| ddWater (RNase free) | 1 ml×32本 |
| Spin Column | 50 本×4 袋 |
製品概要
ISOSPIN Plant RNAは、植物組織からRNAを抽出・精製するためのキットです。本キットは、カオトロピックイオン存在下でRNAがシリカへ吸着する原理を応用しており、フェノールやクロロホルムを使用しません。使用するスピンカラムは、カラム容積を最大限確保しており、内封されたシリカメンブレンは、充分なRNA 吸着容量と高い溶出効率を確保しています。
本キットでは、夾雑物を遠心分離により除去する方法とシリカメンブレン上でのDNase I 処理を採用しており、約1時間で高純度のRNAを抽出・精製できます。
特長
- 高純度RNA
遠心分離による夾雑物の除去とシリカメンブレン上でのDNase I 処理により高純度なRNA抽出が可能です。 - フィルターによる前処理が不要
試料のホモジナイズやろ過を目的としたフィルター処理を必要としません。本キットは遠心分離により夾雑物を沈殿して除去します。 - フェノール、クロロホルムが不要
フェノールやクロロホルムなどの毒性有機溶媒は使用しません。 - DNase I 添付
DNase I (RNase free) がキットに含まれているため、別途購入の必要はありません。 - 抽出困難な植物試料 (松葉やバラ) にはAssist Buffer添加
いままで困難だったマツ (葉)、バラ (葉、花弁)、ツバキ (葉)、ブドウ (果肉、外皮) などからも効率よくRNA抽出可能です。
アプリケーションデータ
RNA収量の目安
| 試料 | RNA収量 |
|---|---|
| ホウレンソウ(歯) | 0.5 μg RNA/mg tissue |
| ブロッコリー(芽生え) | 1.0 μg RNA/mg tissue |
| キャベツ(種子) | 1.3 μg RNA/mg tissue |
| キャベツ(芽生え) | 1.4 μg RNA/mg tissue |
| キャベツ(葉) | 0.1 μg RNA/mg tissue |
| タケ(葉) | 0.3 μg RNA/mg tissue |
| チューリップ(球根) | 0.2 μg RNA/mg tissue |
シロイヌナズナの葉からのRNA抽出(RNA品質の比較)
ISOSPIN Plant RNA およびA社RNA抽出キットを用いて、シロイヌナズナの葉から各社プロトコールに従いRNAを抽出した。抽出したRNAの品質を、バイオアナライザ (Agilent Technologies社) によるRIN値の測定、アガロースゲル電気泳動、および吸光度測定により比較した。
-
■吸光度測定結果
抽出キット A260/A280 A260/A230 RNA収量
(ng/mg tissue)RIN値* ① A社 1.95 1.13 72 7.8 ② ISOSPIN Plant RNA 2.35 2.69 79 7.5 *n=2
-
■アガロース電気泳動
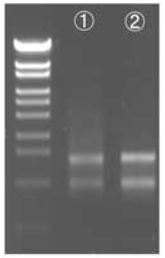
Lane ① : A社キットで抽出したRNA
Lane ② : ISOSPIN Plant RNAで抽出したRNA
各100 ngずつ電気泳動 in 1% Agarose S
■RNAの吸光スペクトル
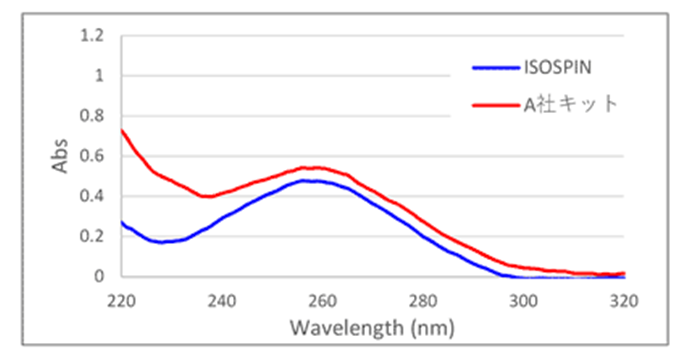
[結果]
ISOSPIN Plant RNAで抽出したRNAは、A社キットで抽出したRNAと比べて、より高品質であることが確認できた。また電気泳動では、各サンプルの吸光度に基づき同じRNA量を泳動しているが、ISOSPINで抽出したRNAはバンドが濃く、高純度であることが示唆された。
Assist Buffer for ISOSPIN Plant RNAの併用によるRNA抽出効率の改善
RNA抽出が困難な植物組織から、ISOSPIN Plant RNAのみ、またはISOSPIN Plant RNAとAssist Buffer for ISOSPIN Plant RNAを併用してRNA抽出を行い、抽出したRNA溶液の吸光スペクトルを比較した。
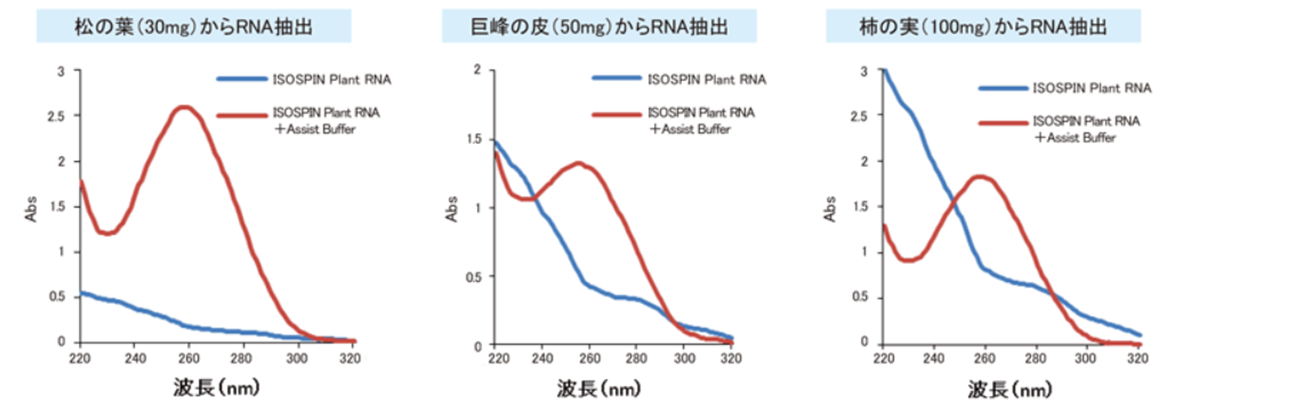
[結果]
ISOSPIN Plant RNAだけではRNA抽出が困難な植物組織において、Assist Buffer for ISOSPIN Plant RNAと併用することにより、RNAの収量や純度を改善することができた。
<効果が確認された植物組織>
ISOSPIN Plant RNAとAssist Buffer for ISOSPIN Plant RNAの併用によりRNA抽出効率の改善が確認された組織
-
植物組織 収量の目安 マツ(葉)※ 0.1 μg RNA/mg tissue バラ(葉)※ 50 μg RNA/mg tissue バラ(花弁)※ 80 μg RNA/mg tissue ツバキ(葉)※ 70 μg RNA/mg tissue ミカン(外皮)※ 80 μg RNA/mg tissue カキ(果肉)※ 30 μg RNA/mg tissue ブドウ(果肉)※ 10 μg RNA/mg tissue ブドウ(外皮)※ 50 μg RNA/mg tissue -
植物組織 収量の目安 バナナ(果肉)※ 15 μg RNA/mg tissue コチョウラン(葉)※ 20 μg RNA/mg tissue シクラメン(葉)※ 0.1 μg RNA/mg tissue イチゴ(葉)※ 0.1 μg RNA/mg tissue トマト(果肉)※ 25 μg RNA/mg tissue トマト(種子)※ 60 μg RNA/mg tissue チャ(葉)※ 0.6 μg RNA/mg tissue ※ISOSPIN Plant RNAだけではRNA抽出が困難な植物組織
NGS解析のための核酸抽出試薬について
ニッポンジーンでは、'簡単' で '高性能' さらに '低コスト' な核酸抽出キット「ISOSPIN シリーズ」を提供しています。
そのラインアップの中から、NGS解析を行う研究者の皆様に向けて、NGSグレードの核酸を抽出するための製品をご紹介いたします。
※動物組織・細胞または植物からのRNA抽出キット、更に糞便からのDNA抽出キットについてご説明いたします。
01:48 動物組織、動物培養細胞からのRNA抽出キット(ISOSPIN Cell & Tissue RNA)
05:15 植物組織からのRNA抽出キット(ISOSPIN Plant RNA)
06:51 糞便試料からのDNA抽出キット(ISOSPIN Fecal DNA)
文献
- Chikashi, H. et al.: Sci Rep., 14, 27410 (2024)
Conservation units and the origin of planted individuals of an endangered endemic species Lobelia boninensis in the Ogasawara Islands - Haruka, O. et al.: Plant and Cell Physiology, 3 (65), 362-371 (2024)
Comparative Analysis of Shikonin and Alkannin Acyltransferases Reveals Their Functional Conservation in Boraginaceae - Kaito, H. et al.: Data in Brief., 59, 111341 (2025)
Gene expression dataset of the blood clam Anadara kagoshimensis in relation to anoxic stress - Akari, H. et al.: J-STAGE., 24, 1030a (2025)
Expression analysis of genes enriched in the pulvinus of Lotus japonicus - Manabu, S. et al.: Life Sciences in Space Research, 44, 79-85 (2025)
Anthocyanin can improve the survival of rice seeds from solar light outside the international space station - Mayu, M. et al.: Molecular ecology, 16 (33), e17466 (2024)
Evolution of secondary metabolites, morphological structures and associated gene expression patterns in galls induced by four closely related aphid species on a host plant species - June-Sik, K. et al.: Sci Data, 12, 197 (2025)
Multiomics-based assessment of the impact of airflow on diverse plant callus cultures - Jun, C. et al.: Bioscience, Biotechnology, and Biochemistry, 2 (88), 220-224 (2024)
Copper ion (Cu2+) is involved in the transcription of the tyrosinase-encoding melB gene of Aspergillus oryzae in solid-state culture - Tatsuyuki, K. et al.: Plants, 13 (17), 2487 (2024)
Ergothioneine Improves Seed Yield and Flower Number through FLOWERING LOCUS T Gene Expression in Arabidopsis thaliana - Yuka, S. et al.: Front. Plant Sci. 15 (2024)
Autonomous differentiation of transgenic cells requiring no external hormone application: the endogenous gene expression and phytohormone behaviors - Yoshiaki, U. et al.: Plant Methods, 20, 187 (2024)
Development of an infiltration-based RNA preservation method for cryogen-free storage of leaves for gene expression analyses in field-grown plants - Tetsuya, Y. et al.: Plant and Cell Physiology, 11 (65), 1743-1750 (2024)
Heritable Tissue-Culture-Free Gene Editing in Nicotiana benthamiana through Viral Delivery of SpCas9 and sgRNA - Takanori, K. et al.: Scientia Horticulturae, 332, 113193 (2024)
Exogenous application of gibberellic acid reduces antioxidant capacity of leaves, resulting in increased Tipburn damages in Lisianthus cultivars - Kazuma, F. et al.: bioRxiv, (2025)
Structure-activity relationships and crucial mechanisms of the coumarin family as germination inhibitors - Takumi, O. et al.: J-STAGE, 4 (41), 343-356 (2024)
Translocation of green fluorescent protein in homo- and hetero-transgrafted plants - Kenji, S. et al.: Plant, Cell & Environment, 8 (47), 2711-3281 (2024)
Freezing treatment under light conditions leads to a dramatic enhancement of freezing tolerance in cold-acclimated Arabidopsis - Yasuo, K. et al.: Biochemistry and Biophysics Reports, 38, 101692 (2024)
Functional characterization of Capsicum chinense vanillin aminotransferase: Detection of vanillylamine-forming activity from vanillin - Kang, X. et al.: Plant Physiology, 2 (196), 1659-1673 (2024)
Exogenous application of the apocarotenoid retinaldehyde negatively regulates auxin-mediated root growth - Yasuhito, S. et al.: Nat Commun, 15, 7913 (2024)
HASTY-mediated miRNA dynamics modulate nitrogen starvation-induced leaf senescence in Arabidopsis - Koki, M. et al.: Antioxidants, 13 (7), 781 (2024)
Diurnal-Rhythmic Relationships between Physiological Parameters and Photosynthesis- and Antioxidant-Enzyme Genes Expression in the Raphidophyte Chattonella marina Complex - Mitsutoshi, K. et al.: Journal of Experimental Botany, 11 (75), 3521-3541 (2024)
Anthocyanins act as a sugar-buffer and an alternative electron sink in response to starch depletion during leaf senescence: a case study on a typical anthocyanic tree species, Acer japonicum - Mengyao, W. et al.: Commun Biol, 7, 102 (2024)
The phosphorylated pathway of serine biosynthesis affects sperm, embryo, and sporophyte development, and metabolism in Marchantia polymorpha - Niarsi, M, H. et al.: Plant and Cell Physiology, 11 (65), 1769-1786 (2024)
Nutrient Requirements Shape the Preferential Habitat of Allorhizobium vitis VAR03-1, a Commensal Bacterium, in the Rhizosphere of Arabidopsis thaliana - Saori, T. et al.: Plant and Cell Physiology, 9 (64), 996-1007 (2023)
A Divergent Clade KAI2 Protein in the Root Parasitic Plant Orobanche minor Is a Highly Sensitive Strigolactone Receptor and Is Involved in the Perception of Sesquiterpene Lactones - Taishi, H. et al.: Genes Genet. Syst, 98, 259-265 (2023)
Development and characterization of expressed sequence tag-simple sequence repeat markers for Anaphalis margaritacea var. yedoensis (Asteraceae) - Keita, T. et al.: DNA Research, 1 (30), dsac044 (2023)
A highly contiguous genome assembly of red perilla (Perilla frutescens) domesticated in Japan - Junpei, U. et al.: Cytologia, 88(1), 61?67 (2023)
Characterization of late heading 1, a Heavy-Ion Beam Irradiation-Induced Mutant in Einkorn Wheat (Triticum monococcum) that Suppresses an Early-Flowering Phenotype in Plants with Deletion of PHYTOCLOCK 1 - Ayako, N. et al.: Bioscience, Biotechnology, and Biochemistry, 87 (10), 1145-1154 82023)
Molecular and cellular insights into auxin-regulated primary root growth: a comparative study of Arabidopsis and rice - Emdadul, H. et al.: Front. Plant Sci, 14 (2023)
Polyploid GWAS reveals the basis of molecular marker development for complex breeding traits including starch content in the storage roots of sweet potato - Shizuka, K. et al.: DNA Research, 30 (5), dsad019 (2023)
Genome and transcriptome analyses reveal genes involved in the formation of fine ridges on petal epidermal cells in Hibiscus trionum - Masanobu, N. et al.: J Virol, 97 (6), e00221-23 (2023)
Interaction of EXA1 and eIF4E Family Members Facilitates Potexvirus Infection in Arabidopsis thaliana - Quanshu, L. et al.: Plant Production Science, 26(1), 65?75 (2023)
Deepwater response in the African cultivated rice Oryza glaberrima. - Ryuhei, E. et al.: Appl Environ Microbiol, 89, e01458-23 (2023)
Identification of an operon and its regulator required for autoaggregation in Tetragenococcus halophilus - Hayato, H. et al.: Front. Plant Physiol, 30 (2023)
Cold acclimation is affected by diurnal cycles and minute-scale random temperature fluctuations via calcium signals - Yuka, S. et al.: Biomolecules, 13 (2), 208 (2023)
Behavior of Male Gamete Fusogen GCS1/HAP2 and the Regulation in Arabidopsis Double Fertilization
FAQ
トラブルシューティング
- RNA抽出効率が悪い場合の改善方法はありますか。
- 試料のホモジナイゼーションまたは溶解が不十分だと、PT Extraction Buffer (植物用) に触れていない細胞内部でのRNA分解が進みます。組織の摘出を素早くすることと、効果的にホモジナイズすることが重要です。
使用実績
- ISOSPIN Plant RNAで抽出したRNAをRNA-seq解析に使用した実績はありますか。
- 東京大学植物病理学研究室の以下論文にて、RNA-seq解析のRNA抽出に本キットをご使用いただいております。
Tokuda R, Nishikawa M, Hosoe N, Nijo T, Iwabuchi N, Yoshida T, Watanabe K, Maejima K, Yamaji Y, Namba S. (2019) Complete Genome Sequence of a Carrot Torradovirus 1 Isolate, Obtained from Angelica. Micorobiology. 8 (15): e00110-19
物性情報
「物性情報」は参考情報でございます。規格値を除き、この製品の性能を保証するものではございません。
本製品の品質及び性能については、本品の製品規格書をご確認ください。
なお目的のご研究に対しましては、予備検討を行う事をお勧めします。
製造元情報
別名一覧
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 製品規格・包装規格の改訂が行われた場合、画像と実際の製品の仕様が異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。







