アイソスピン プラントRNA (DNase Iなし)
ISOSPIN Plant RNA (w/o DNase I)
- 製造元 :
- (株)ニッポンジーン
- 保存条件 :
- 室温
- 適用法令 :
- PRTR-1 安衛法57条・有害物表示対象物質 労57-2 優先評価物質 危4-ア(水溶性)-II
- GHS :
-
- 構造式
- ラベル
- 荷姿
|
比較
|
製品コード
|
容量
|
価格
|
在庫 / 納期目安
|
|
|---|---|---|---|---|---|
|
|
|
50テスト
|
|
|
|
ドキュメント
- 添付文書
-
- スペクトルデータ
-
- 検査成績書
-
- 校正証明書
-
- 分析チャート
-
キットコンポーネント
50回用
| PT Extraction Buffer (植物用) | 30 ml x 1本 |
|---|---|
| PT Binding Buffer (植物用) | 40 ml x 1本 |
| PT Wash1 Buffer | 40 ml x 1本 |
| PT Wash2 Buffer | 40 ml x 1本 |
| ddWater (RNase free) | 1 ml x 8本 |
| Spin Column | 50 本 x 1袋 |
製品概要
本キットは、「ISOSPIN Plant RNA」 にDNase Iが添付されていない50回用のパッケージです。
冷凍保存(-20℃)が必要な酵素が含まれていないため、本キットは室温で保存が可能です。
別売りのDNase I (RNase free)と組み合わせてご使用ください。
特長
- 高純度RNA
遠心分離による夾雑物の除去とシリカメンブレン上でのDNase I *処理により高純度なRNA抽出が可能です。
*:本キットにはDNase Iは含まれておりません。 - フィルターによる前処理が不要
試料のホモジナイズやろ過を目的としたフィルター処理を必要としません。本キットは遠心分離により夾雑物を沈殿して除去します。
- フェノール、クロロホルムが不要
フェノールやクロロホルムなどの毒性有機溶媒は使用しません。
- 抽出困難な植物試料(松葉やバラ)にはAssist Buffer添加
いままで困難だったマツ(葉)、バラ(葉、花弁)、ツバキ(葉)、ブドウ(果肉、外皮)などからも効率よくRNA抽出可能です。
使用例
プロトコール

*本キットにDnase Iは添付されておりません。 RNA収量の目安
本品で得られるRNAの収量の目安は次の通りである。
試料 ホウレンソウ(葉) 0.5 μg RNA/mg tissue ブロッコリー(芽生え) 1.0 μg RNA/mg tissue キャベツ(種子) 1.3 μg RNA/mg tissue キャベツ(芽生え) 1.4 μg RNA/mg tissue キャベツ(葉) 0.1 μg RNA/mg tissue タケ(葉) 0.3 μg RNA/mg tissue チューリップ(球根) 0.2 μg RNA/mg tissue シロイヌナズナの葉からのRNA抽出(RNA品質の比較)
ISOSPIN Plant RNA およびA社RNA抽出キットを用いて、シロイヌナズナの葉から各社プロトコールに従いRNAを抽出した。抽出したRNAの品質を、バイオアナライザ(Agilent Technologies社)によるRIN値の測定、アガロースゲル電気泳動、および吸光度測定により比較した。
<吸光度測定結果とRIN値> 抽出キット A260/A280 A260/A230 RNA收量
(ng/mg tissue)RIN值* ① A社 1.95 1.13 72 7.8 ② ISOSPIN Plant RNA 2.35 2.69 79 7.5 *n=2
<RNAの吸光スペクトル> 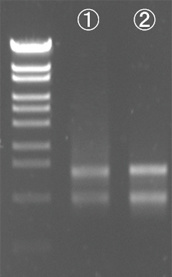
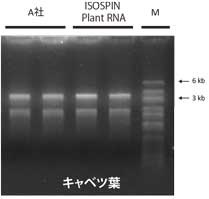
Lane ① : A社キットで抽出したRNA
Lane ② : ISOSPIN Plant RNAで抽出したRNA
各100 ngずつ電気泳動in 1% Agarose S結果
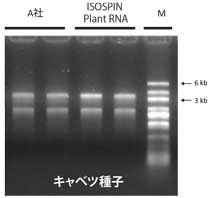
ISOSPIN Plant RNAで抽出したRNAは、A社キットで抽出したRNAと比べて、より高品質であることが確認できた。また電気泳動では、各サンプルの吸光度に基づき同じRNA量を泳動しているが、ISOSPINで抽出したRNAはバンドが濃く、高純度であることが示唆された。
シロイヌナズナの根からのRNA抽出(RNA品質の比較)
ISOSPIN Plant RNA およびA社RNA抽出キットを用いて、シロイヌナズナの根から各社プロトコールに従いRNAを抽出した。抽出したRNAは、バイオアナライザ(Agilent Technologies社)を用いたRNA Integrity Number (RIN値) の測定を行った。
<RIN値> 抽出キット RIN値* A社 5.8 ISOSPIN Plant RNA 7.3 *n=1
結果
ISOSPIN Plant RNA を用いて高品質なRNAを抽出できていることが確認できた。
(RNA量が微量のため、両キット共に吸光度測定や電気泳動での検出はできなかった)キャベツ(アブラナ科)種子および葉からのRNA抽出
ISOSPIN Plant RNAと他社製品を用いて、プロトコールに従ってキャベツの種子(約4 mg)および葉(約30 mg)からRNAを抽出した。抽出したRNAは、吸光スペクトル測定およびゲル電気泳動により比較した。さらに、抽出したTotal RNAを鋳型に逆転写を行い、得られたcDNAをGeneAce SYBR™ qPCR Mix α Low ROXを用いてリアルタイムqPCRを行った。
実験条件
- サンプル量
- 種子(約4 mg)
- 葉(約30 mg)
- 変性ゲル電気泳動
- ゲル:1% Agarose S(ホルムアルデヒド変性)
- RNA添加量:種子(1μg)/葉(0.5μg)
- RNA Ladder:RNA添加量と同量
- リアルタイムqPCR
- 試薬:GeneAce SYBR™ qPCR Mix α Low ROX
- 装置:ABI 7500 Fast
- 鋳型cDNA:抽出したTotal RNAを鋳型に逆転写
- 増幅鎖長:441 bp
- テスト数: n=3
結果
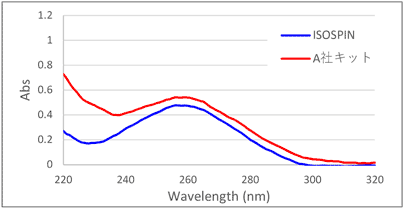
吸光度スペクトル測定結果より、ISOSPIN Plant RNAはA社より低いA230の値を示し、多糖類などの夾雑物が効率良く除去できていることが分かった(図1)。
キャベツ種子 キャベツ葉 図1 吸光スペクトル測定
図2 変性ゲル電気泳動
- 【RNA添加量】
- 種子(1μg)/葉(0.5μg)
- 【Marker】
- RNA Ladder(RNA添加量と同量)
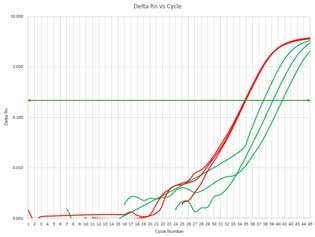
1% Agarose S(ホルムアルデヒド変性)キャベツ種子 キャベツ葉 図3 リアルタイムqPCR
- 【試薬】
- GeneAce SYBR™ qPCR Mix α Low ROX
- 【鋳型】
- 抽出したTotal RNAを鋳型に逆転写
- 【装置】
- ABI 7500 Fast
- 【増幅鎖長】
- 441 bp
- 【テスト数】
- n=3
- 赤色:ISOSPIN Plant RNA
- 緑色:A社製品
タケ(イネ科)カルスからのRNA抽出
ISOSPIN Plant RNAと他社製品を用いて、プロトコールに従って各量のタケカルスからRNAを抽出した。抽出したRNAは、吸光スペクトル測定およびゲル電気泳動により比較した。さらに、抽出したTotal RNAを鋳型に逆転写を行い、得られたcDNAをGeneAce SYBR™ qPCR Mix α Low ROXを用いてリアルタイムqPCRを行った。
※本実験で使用した竹のカルスは、富山県立大学 荻田信二郎博士(現、公立大学法人県立広島大学)よりご提供頂きました。尚、使用したタケカルスは理化学研究所バイオソースセンターへ委託されたハチク培養細胞Pn(rpc00047)株から形成されたものです。

タケカルス
(ハチク培養細胞Pn(rpc00047)株から形成)実験条件
- サンプル量
① 約65 mg
② 約50 mg
③ 約40 mg
- アガロースゲル電気泳動
- ゲル:0.8% Agarose S/TAE
- RNA添加量:最終溶出量の1/10(5 μl)
- Marker:OneSTEP Marker6(5 μl)
- リアルタイムqPCR
- 試薬:GeneAce SYBR™ qPCR Mix α Low ROX
- 装置:ABI 7500 Fast
- 鋳型cDNA:抽出したTotal RNAを鋳型に逆転写
- 増幅鎖長:197 bp
- テスト数: n=3
結果
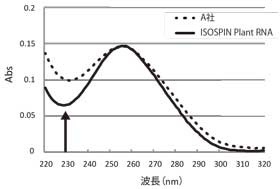
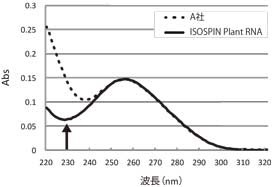
吸光度スペクトル測定結果では、ISOSPIN Plant RNAはA社より低いA230の値を示すことから、多糖類などの夾雑物が効率良く除去できていることが分かった(図1)。また、アガロースゲル電気泳動で比較した結果からも、ISOSPIN Plant RNAは効率よくRNAを抽出できていることが確認できた(図2)。
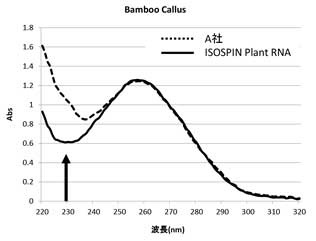
図1 吸光スペクトル測定 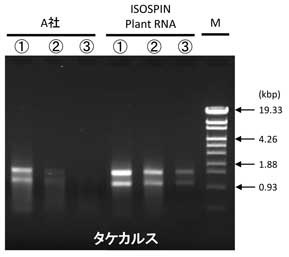
図2 アガロースゲル電気泳動
- 【ゲル】
- 0.8% Agarose S/TAE
- 【RNA添加量】
- 最終溶出量の1/10(5 μl)
- 【Marker】
- OneSTEP Marker6(5 μl)
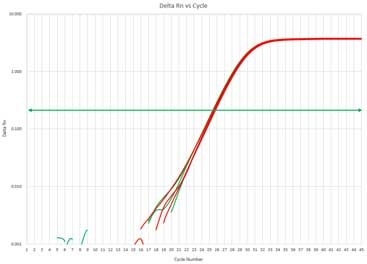
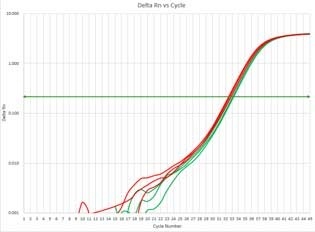
図3 リアルタイムqPCR
- 【試薬】
- GeneAce SYBR™ qPCR Mix α Low ROX
- 【装置】
- ABI 7500 Fast
- 【鋳型cDNA】
- 抽出したTotal RNAを鋳型に逆転写
- 【増幅鎖長】
- 197 bp
- 【テスト数】
- n=3
チューリップ(ユリ科)球根からのRNA抽出
ISOSPIN Plant RNAとB社製品を用いて、プロトコールに従ってチューリップ球根(100 mg)からRNAを抽出した。抽出したRNAは、吸光スペクトル測定およびゲル電気泳動により比較した。さらに、抽出したTotal RNAを鋳型に逆転写を行い、得られたcDNAをGeneAce SYBRR qPCR Mix α Low ROXを用いてリアルタイムqPCRを行った。
チューリップ球根サンプルは粘性が高く、抽出が難しいとされている。右写真は、チューリップの球根を液体窒素ですり潰して粉末状にした後、1.5 mlチューブに量り取り、各社の抽出Buffer中でペッスルにてすり潰した後の様子である。チューブを逆さにして溶液の粘性を比較した。

抽出液の粘性の様子
左:ISOSPIN Plant RNA
右:B社製品実験条件
- サンプル量
100 mg
- アガロースゲル電気泳動
RNA添加量:最終溶出量の1/10(5 μl)
結果
ISOSPIN Plant RNAは粘性の高いチューリップ球根からもRNAを抽出できた。
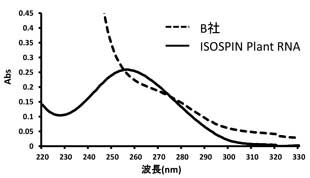
図1 吸光スペクトル測定 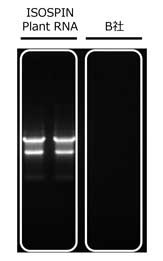
最終溶出量の1/10(5 μl)
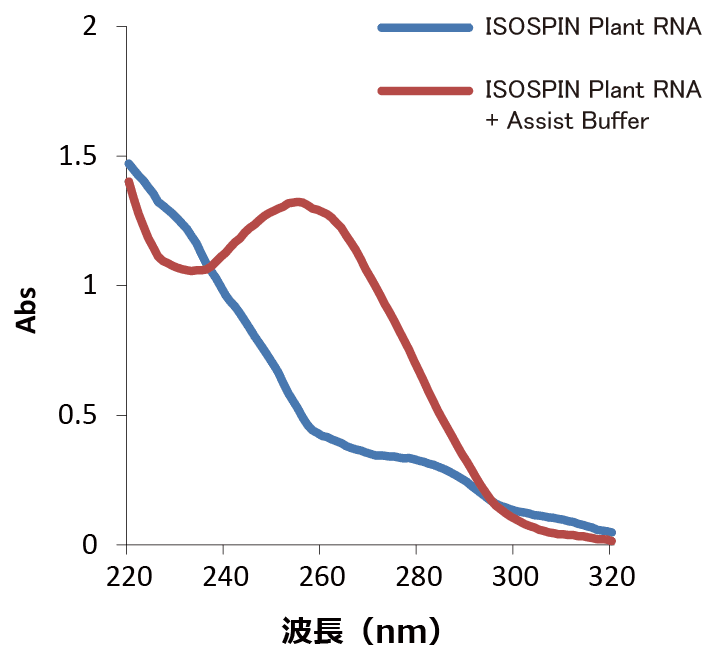
図2 アガロースゲル電気泳動Assist Buffer for ISOSPIN Plant RNA を使用して、杉の葉からのRNA抽出
杉の葉は、粉砕すると粘性物を大量に放出するため、溶液の粘性が高くなりRNA抽出が困難となる。Assist Buffer を組み合わせたISOSPIN Plant RNA オプションプロトコールで、杉の葉 30 mgからRNAを抽出できるか検討した。
実験条件
- ① ISOSPIN Plant RNAキット単独の標準プロトコール(製品マニュアル p.3~5参照)
- ② 本キットとAssist Buffer for ISOSPIN Plant RNA を組み合わせた通常のオプションプロトコール(製品マニュアル p.6~9)
- ③ TEによる前処理工程後*1、② の通常オプションプロトコール(製品マニュアル p.6のステップ ② 注釈、参照)
*1 前処理工程:TE(pH8.0)中でペッスルで軽くすり潰し、遠心分離(13,000 x g、4℃、10分)を行う。- ④ TEによる前処理工程後*1、② のオプションプロトコール、洗浄工程を改変*2(製品マニュアル p.7のステップ ⑲ 参照)
*2 PT Wash2 Buffer で 600 μl x 1回洗浄するところ、300 μl x 2回に変更。結果
スギの葉は、キットのみでは抽出困難だったが、Assist Buffer for ISOSPIN Plant RNA を組み合わせたオプションプロトコールを行うことでRNA抽出可能だった。また、TEによる前処理工程や、改変して洗浄工程を加えることでより高純度なRNAを抽出できた。
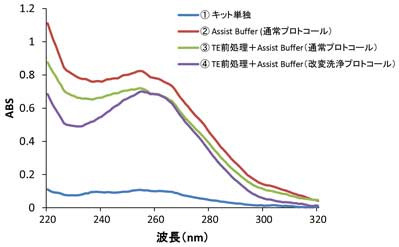
1/50量をNanodrop2000で測定 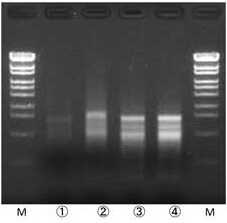
Lane ① キット単独
Lane ②: Assist Buffer (-)
Lane ③: TE+Assist Buffer(通常プロトコール)
Lane ④ TE+Assist Buffer(改変洗浄プロトコール)Agarose S/TAE (非変性) で1/10量を電気泳動 https://www.nippongene.com/siyaku/product/extraction/isospin-plant/isospin-plant-rna.html 「ISOSPIN Plant RNA」と「Assist Buffer for ISOSPIN Plant RNA」の併用によりRNA抽出効率の改善
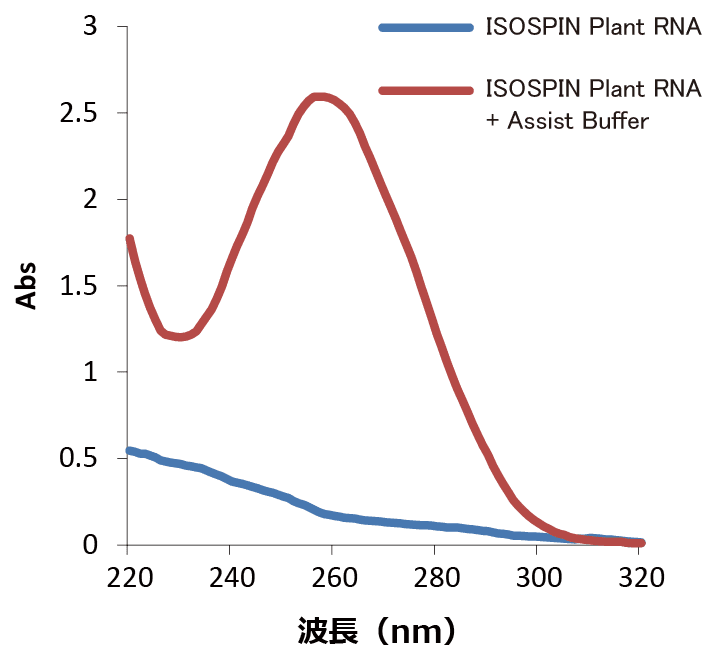
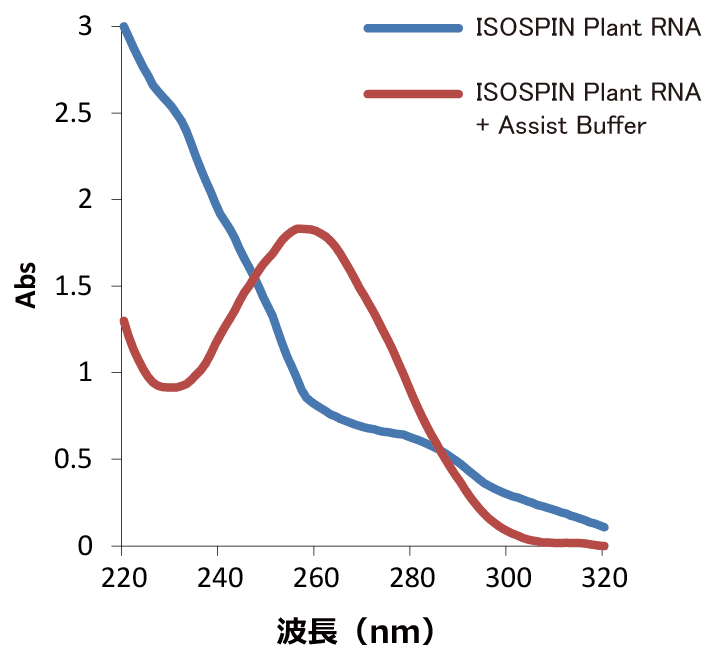
RNA抽出が困難な植物組織から、「ISOSPIN Plant RNA」のみ、または「ISOSPIN Plant RNA」と「Assist Buffer forISOSPIN Plant RNA」を併用してRNA抽出を行い、抽出したRNA溶液の吸光スペクトルを比較した。
松の葉(30mg)からRNA抽出 巨峰の皮(50mg)からRNA抽出 柿の実(100mg)からRNA抽出 結果
「ISOSPIN Plant RNA」だけではRNA抽出が困難な植物組織において、「Assist Buffer for ISOSPIN Plant RNA」と併用することにより、RNAの収量や純度を改善することができた。
効果が確認された植物組織
「ISOSPIN Plant RNA」と「Assist Buffer for ISOSPIN Plant RNA」の併用によりRNA抽出効率の改善が確認された組織。
植物組織 収量の目安
(RNA/mg tissue)マツ(葉)*1 0.1 μg バラ(葉)*1 50 ng バラ(花弁)*1 80 ng ツバキ(葉)*1 70 ng ミカン(外皮)*1 80 ng カキ(果肉)*1 30 ng ブドウ(果肉) *1 10 ng ブドウ(外皮) *1 50 ng バナナ(果肉) *1 15 ng
植物組織 収量の目安
(RNA/mg tissue)コチョウラン(葉)*1 20 ng シクラメン(葉)*1 0.1 μg イチゴ(葉)*1,*2 0.1 μg ジャガイモ(根茎) 0.1 μg ネギ(葉) 0.1 μg トマト(果肉) 25 ng トマト(種子) 60 ng チャ(葉) 0.6 μg *1. 「ISOSPIN Plant RNA」のみでは抽出が困難な植物組織.
*2. イチゴ(葉)はAssist Bufferの添加比率を変更することでより高純度なRNAが得られます。詳細は以下Q&Aをご覧ください。
FAQ
- イチゴの葉からのRNA抽出において、純度を改善したい。
- 別売りの「Assist Buffer for ISOSPIN Plant RNA」の添加比率を変更することで高純度なRNAが得られることを確認しています。イチゴの葉においては、500 μlのPT Extraction Buffer (植物用)に10 μlのAssist Buffer 1 と40 μlのAssist Buffer 2を加えて混和し、550 μlの抽出液を調製してください(以降はマニュアルに従う)。
- RNA抽出効率が悪い場合の改善方法はありますか。
- 試料のホモジナイゼーションまたは溶解が不十分だと、PT Extraction Buffer (植物用) に触れていない細胞内部でのRNA分解が進みます。 組織の摘出を素早くすることと、効果的にホモジナイズすることが重要です。 参考資料 各種試料のホモジナイズ方法
- ISOSPIN Plant RNAで抽出したRNAをRNA-seq解析に使用した実績はありますか?
- 東京大学植物病理学研究室の以下論文にて、RNA-seq解析のRNA抽出に本キットをご使用頂いております。
Tokuda R, Nishikawa M, Hosoe N, Nijo T, Iwabuchi N, Yoshida T, Watanabe K, Maejima K, Yamaji Y, Namba S. (2019) Complete Genome Sequence of a Carrot Torradovirus 1 Isolate, Obtained from Angelica. Micorobiology. 8 (15): e00110-19
製造元情報
別名一覧
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 製品規格・包装規格の改訂が行われた場合、画像と実際の製品の仕様が異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。