同仁化学 Glycolysis/OXPHOS Assay Kit

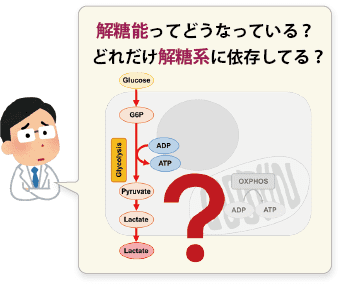
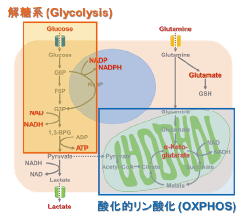
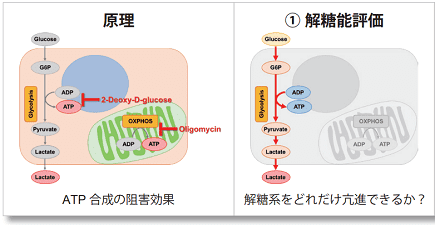
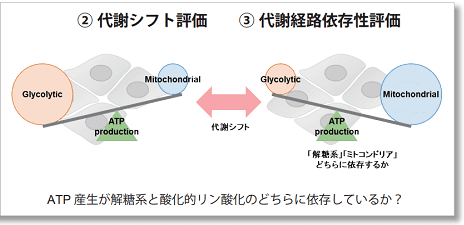
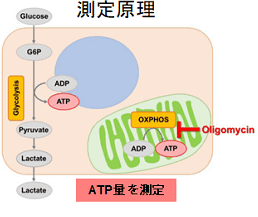
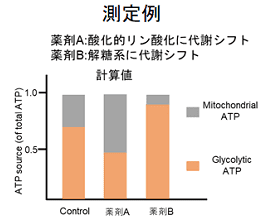
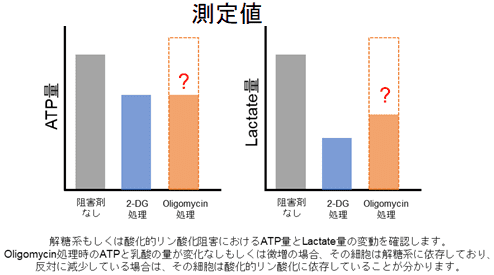
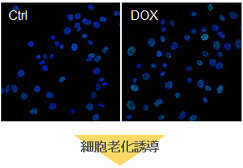
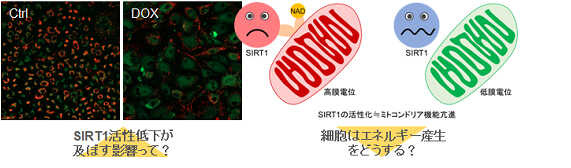
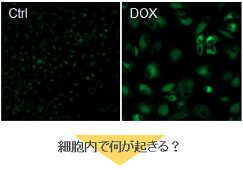
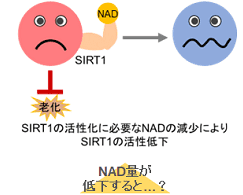
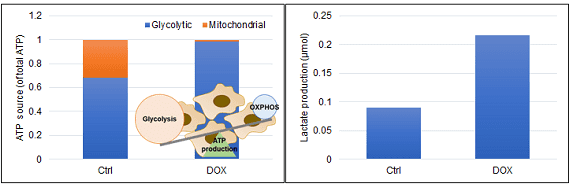
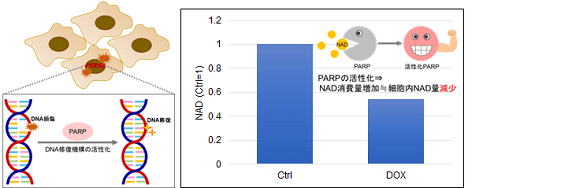
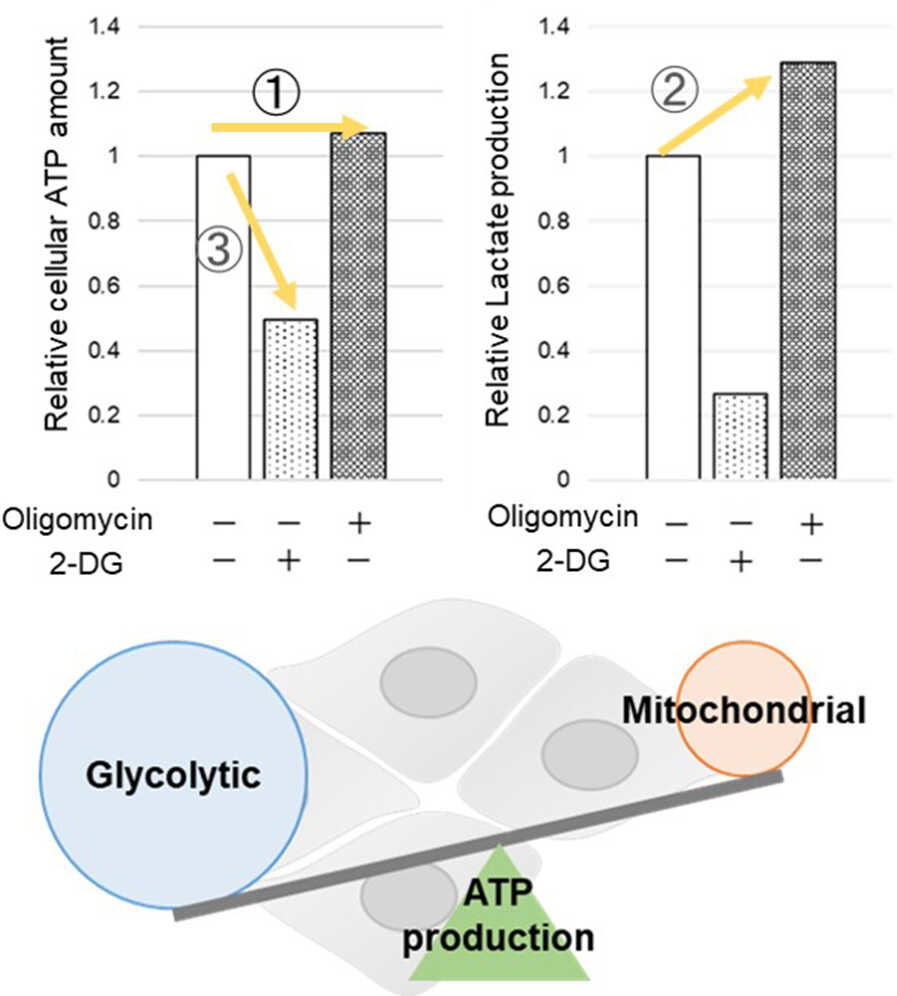
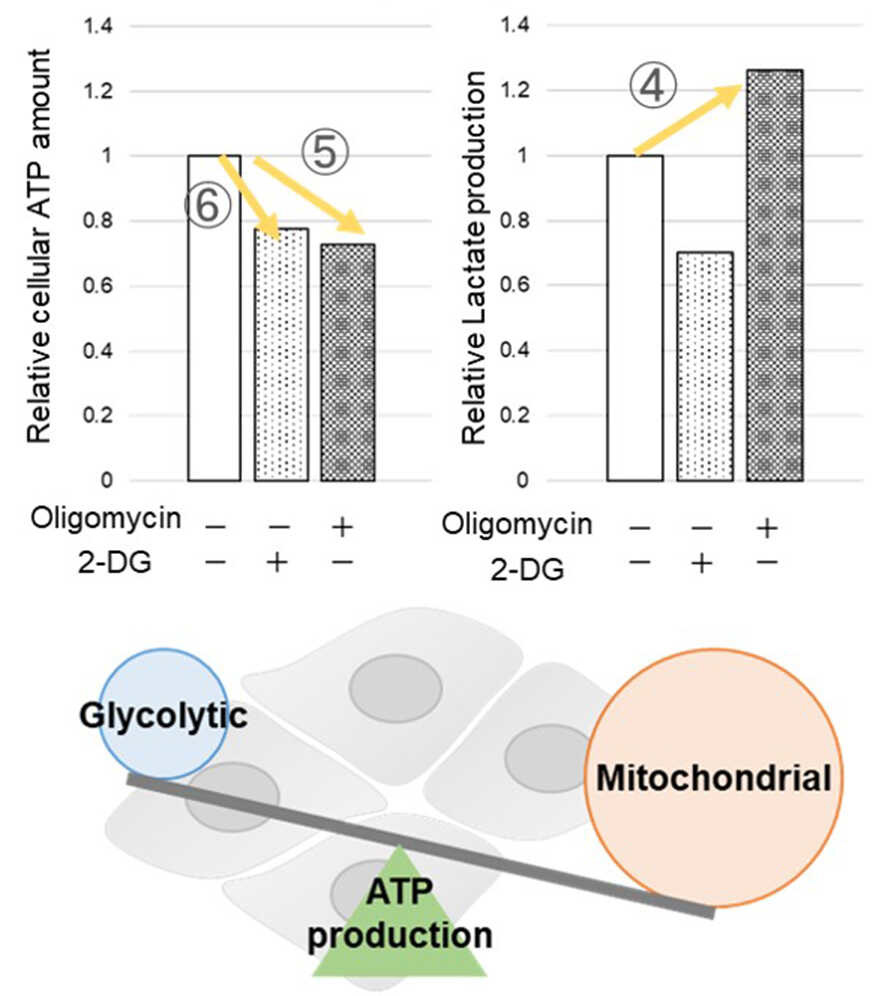
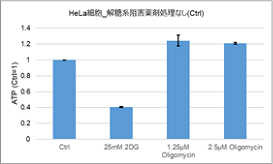
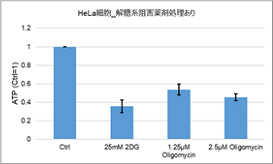
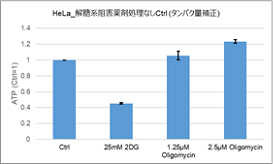
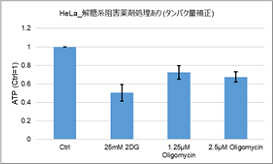
多くのがん細胞は、解糖系に依存したエネルギー代謝によりATPを産生しています。一方で、解糖系が抑制されたがん細胞は、ミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ生存していることが、近年報告されています。これらの現象を理解することは、抗がん剤のメカニズム解明に役立つだけではなく、老化、神経変性疾患を含む様々な疾患における治療戦略の開発に繋がるため、注目を集めています。
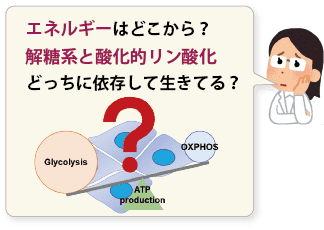
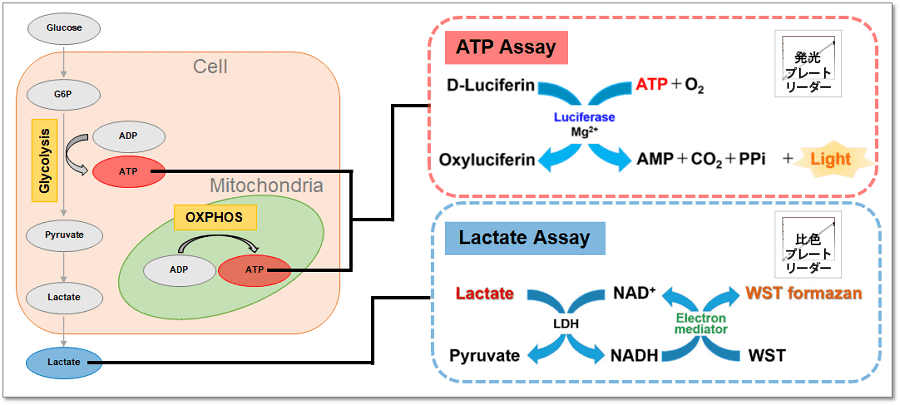
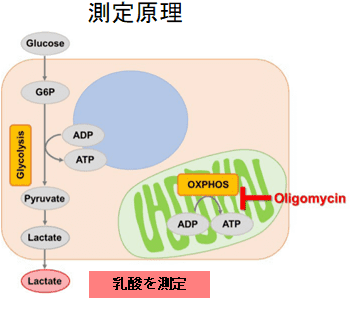
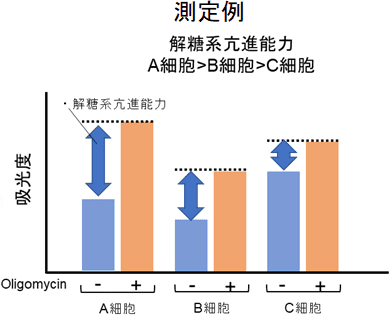
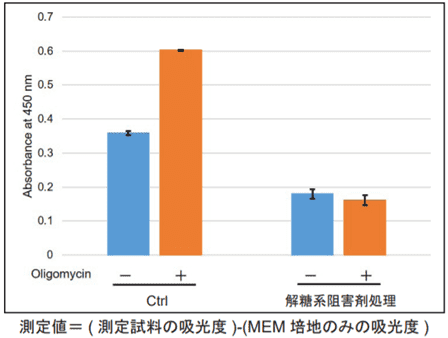
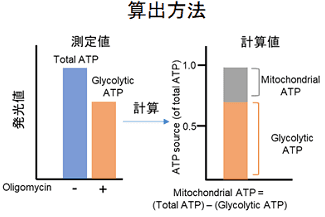
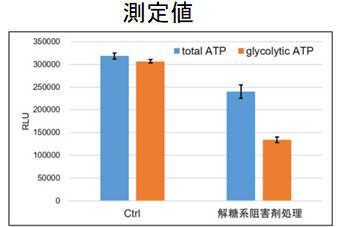
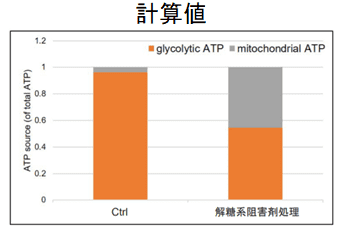
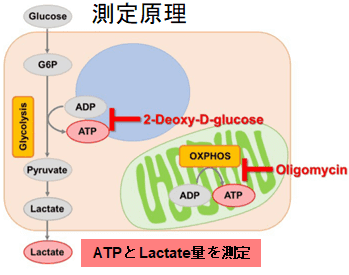
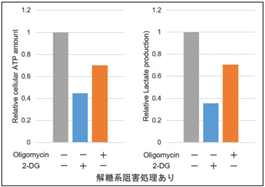
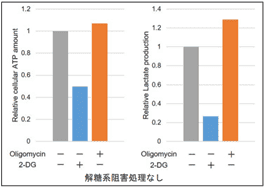
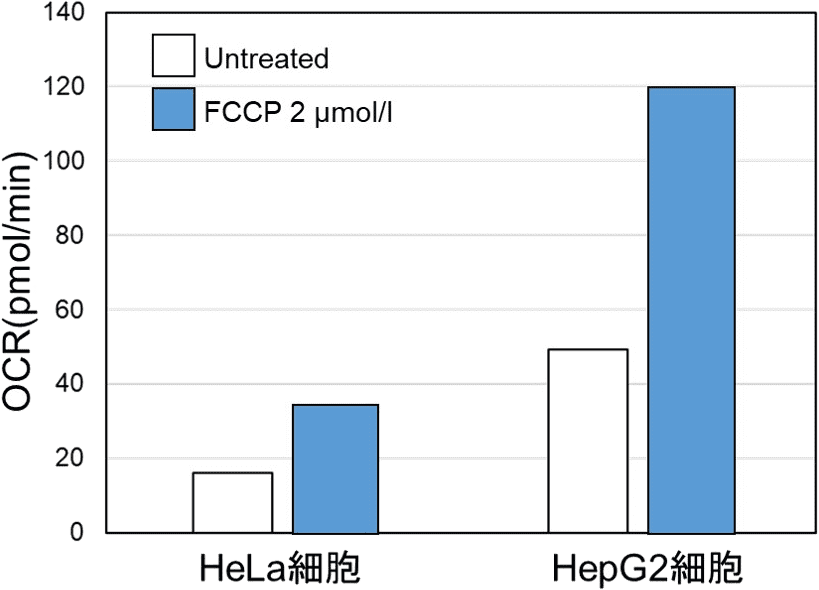
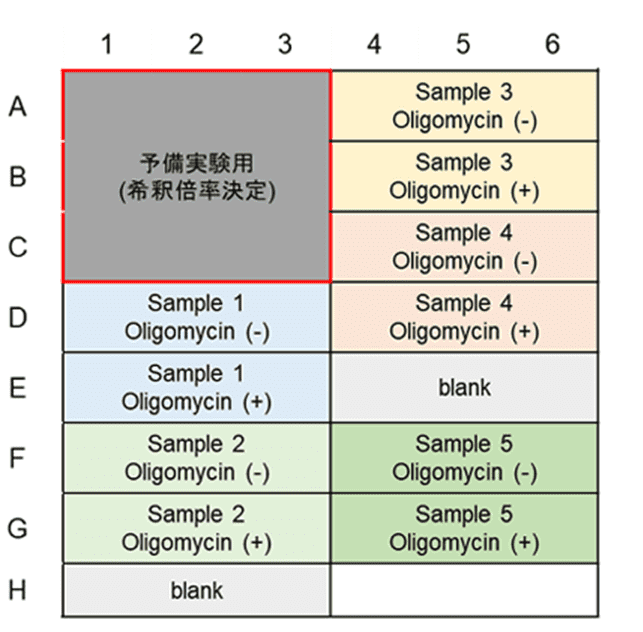
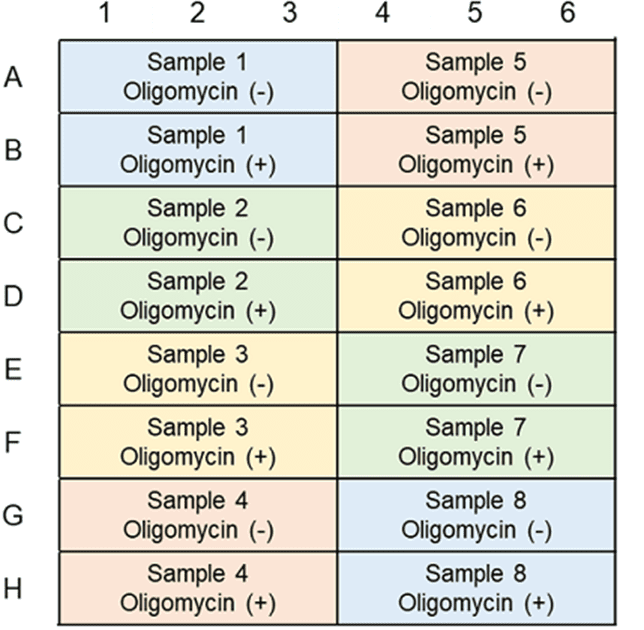
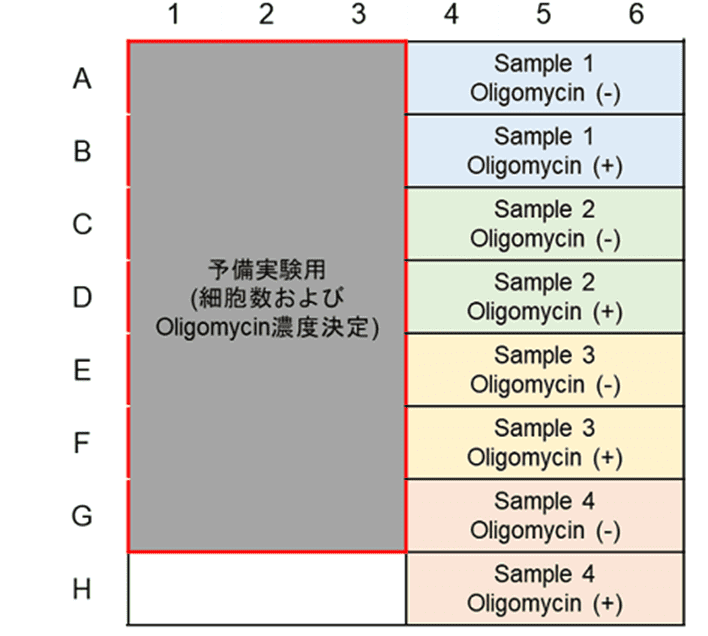
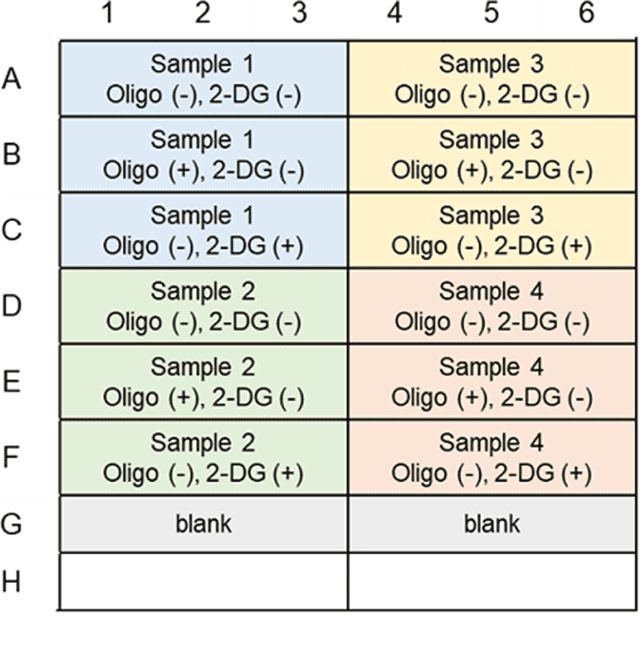
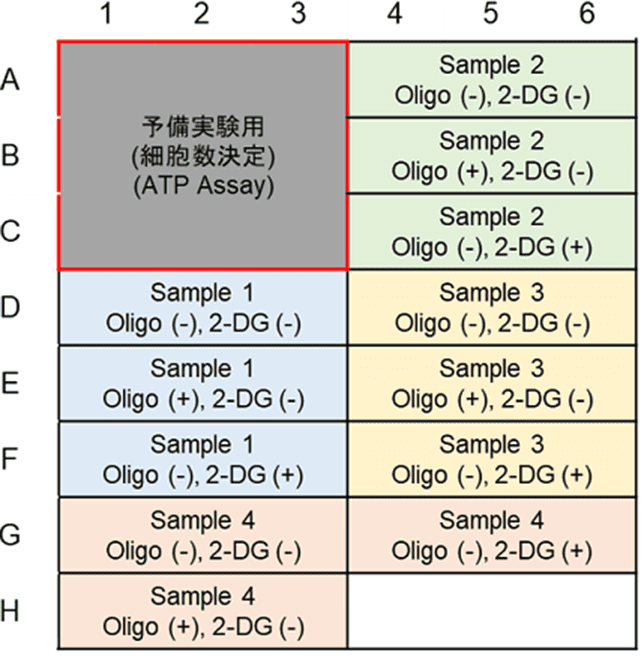
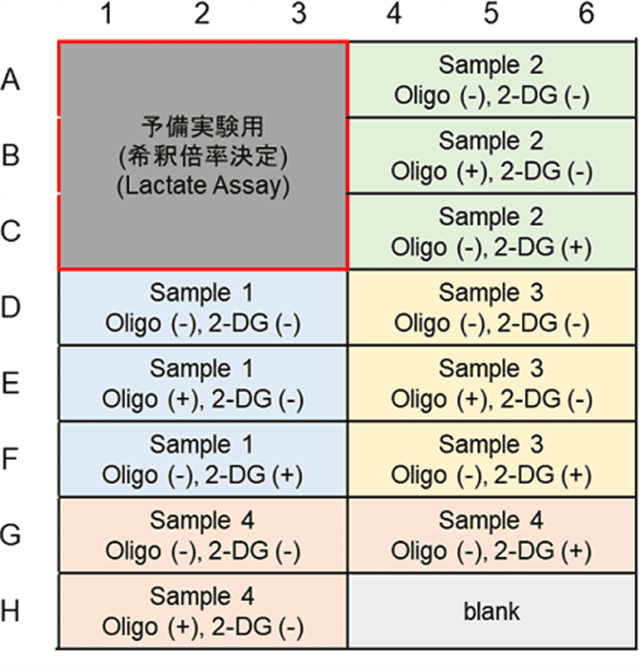
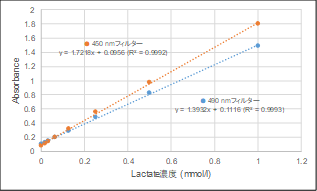
本キットは、解糖能、代謝シフトおよび、細胞が解糖系と酸化的リン酸化のどちらに依存してエネルギー産生を行っているのかをプレートリーダーを用いて評価するキットです。 本キットには、これらの評価に必要な試薬が全て同梱されています。