残留DNA検査:抽出・検出
バイオ医薬品の製造工程において、宿主細胞のDNAは、腫瘍形成の原因になる恐れがあり、製造工程由来不純物として管理する必要があります。
世界保健機関 (WHO) 、米国食品医薬品局 (FDA) 、欧州薬局方 (EP) では、最終的な宿主由来の残留DNA量を10 ng/doseもしくは100 pg/dose未満とする指針が示されています。
当社では、大腸菌、CHO細胞の残留DNAを検出・定量するqPCRキット、および残留DNAを抽出・精製するキットを販売しています。
抗体医薬品およびその製造プロセスの残留DNA検査にご使用いただけます。
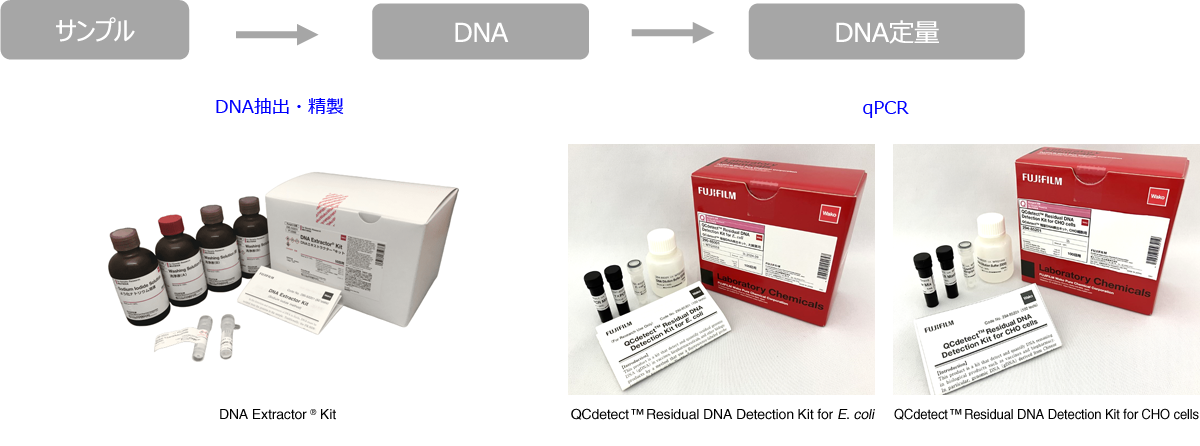
QCdetect ™ Residual DNA Detection Kit for E. coli
本製品は、大腸菌由来のゲノムDNAをqPCR (プローブ法) で定量するキットです。
バイオ医薬品の品質管理及び製造プロセス開発における宿主細胞由来の残留DNA検査にご使用ください。
- Pre-mixの溶液設計によりReady-to-Use
- 検出下限:≧ 0.03 pg/test
- 定量下限:≧ 0.3 pg/test
- Internal Control含有
- 直線性の高い検量線
- アッセイ間差が少なく再現性が高い
- サンプル中の夾雑物の影響を受けにくい
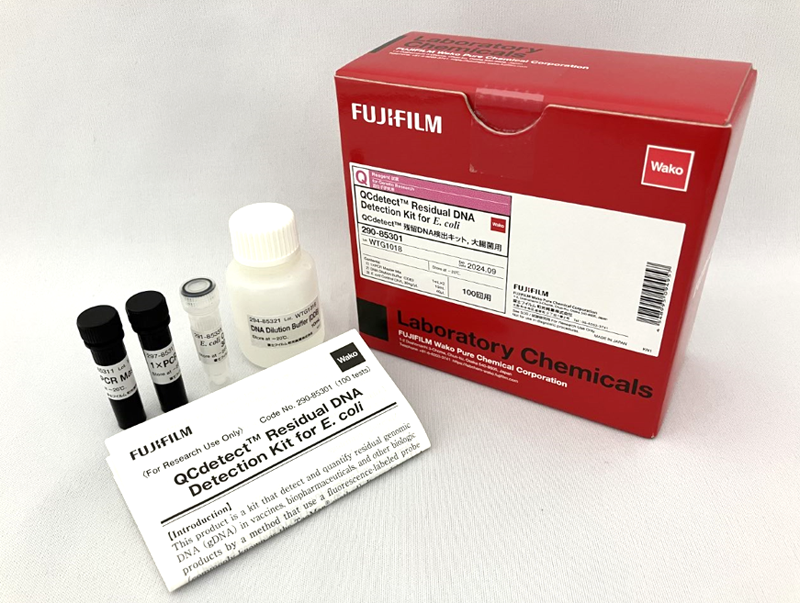
QCdetect ™ Residual DNA Detection Kit for CHO cells
本製品は、CHO細胞由来のゲノムDNAをqPCR (プローブ法) で定量するキットです。
バイオ医薬品の品質管理及び製造プロセス開発における宿主細胞由来残留DNA検査にご使用ください。
- Pre-mixの溶液設計によりReady-to-Use
- 検出下限:≧ 0.0003 pg/test
- 定量下限:≧ 0.003 pg/test
- Internal Control含有
- 直線性の高い検量線
- アッセイ間差が少なく再現性が高い
- サンプル中の夾雑物の影響を受けにくい
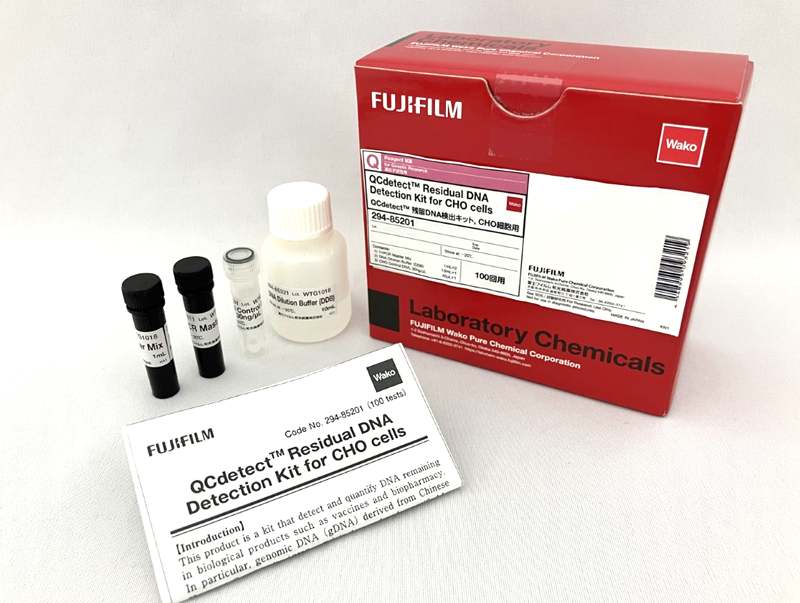
DNA Extractor® Kit
残留する宿主細胞由来のDNAをよう化ナトリウム法で抽出するキットです。 抽出したDNAはqPCRで定量できます。
CHO細胞、大腸菌、酵母など宿主細胞由来DNA量の検査、管理にQCdetect™ Residual DNA Detection Kit と合わせてご使用ください。
- 微量DNAを高い収率で回収
- チューブ交換不要 (チューブ1本で全行程完了)
- スタートから抽出完了まで60 - 90分間
- 高濃度タンパク質含有サンプル用プロトコルあり
- よう化ナトリウム法 *採用
<509>Residual DNA Testingで紹介されている残留DNA抽出法です。
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
CHO由来DNA検出キット
大腸菌由来DNA検出キット
DNA抽出キット
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。
Share



