リシルエンドペプチダーゼR、質量分析グレード (Lys-C)
Lysyl EndopeptidaseR, Mass Spectrometry Grade (Lys-C)
- プロテオーム研究用
-
for Proteome Research
- 製造元 :
- 富士フイルム和光純薬(株)
- 保存条件 :
- 冷凍 (ドライアイス輸送)
- CAS RN® :
- 123175-82-6
- 構造式
- ラベル
- 荷姿
|
比較
|
製品コード
|
容量
|
価格
|
在庫 / 納期目安
|
|
|---|---|---|---|---|---|
|
|
|
20μg×5
|
|
|
|
|
|
|
20μg
|
|
|
ドキュメント
アプリケーション
トリプシン(Tp)、リシルエンドペプチダーゼ(Lep)およびこれらを併用した場合の比較
SDS-PAGE後のBSAバンド(100 ng)をトリプシン、リシルエンドペプチダーゼ®およびこれらの併用によってゲル内消化し、MALDI-TOFMSを用いて質量分析しました。図にはそのマススペクトル、表にはその評価を示しました。
図 Tp単独とTpとLepを併用した場合の質量分析スペクトル
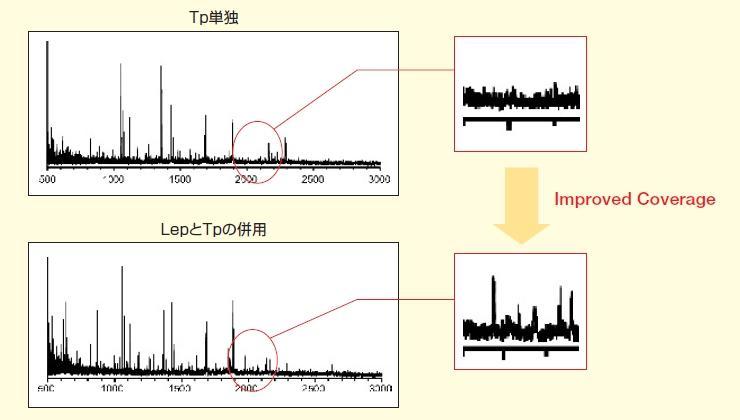
TpとLepの併用では、Tp単独では得られないピークが、m/z 2000付近に得られました。これはペプチドの回収率が上がったことを示します。
表 TpとLepおよびこれらを併用した場合の比較
| Tp | Lep | Tp と Lep の併用 | |
|---|---|---|---|
| 切断部位 | Arg, Lysの C末端 | Lysの C末端 | Arg, Lysの C末端 |
| Missed Cleavage(切れ残ったペプチドの割合)※ | 多い (8 %) |
ほとんどない (0 %) |
少ない (3 %) |
| 同定できたペプチド数 | 17 | 19 | 22 |
※Missed Cleavage 1でデータベース検索した時のCoverage(得られたペプチドが配列全体に占める割合)からMissed Cleavage 0で検索した時のCoverageを引いた値。
Lep単独使用では、Missed Cleavageがほとんどないことがわかります。TpとLepの併用では、Tp単独と比較してMissed Cleavageが減少し、同定できたペプチド数が増加しています。
データ提供:大阪府立母子医療センター 和田芳直先生
参考文献
- Wada, Y. and Kadoya, M.:J. Mass Spectrom., 38, 117(2003).
- Shevchenko, A., Wilm, M., Vorm, O. and Mann, M.:Anal. Chem., 68, 850(1996).
概要・使用例
| 概要 | 本品は、質量分析装置を用いたプロテオーム解析の前処理(ゲル内消化)に使用します。一般に使用されるトリプシンと比較して、ポリペプチド鎖の切断部位を確実に切断するため、より精度の高い蛋白質の同定が可能です。また、使用量に応じて微量小分けした商品ですので、溶解後に小分けして凍結保存する必要がありません。20μg/本は、100~200サンプルのゲル内消化に使用できます。 (Wako Bio Window No.73, p4 (2006.2)) (Wako Bio Window No.102, p3 (2010.4)) (和光純薬時報 Vol.78 No.2, p25 (2010.4)) タンパク質およびペプチドのリシン残基のカルボキシル基側のペプチド結合(Lys-X)を特異的に切断する酵素です。質量分析用に微量小分けしています。 タンパク質の切断部位を特異的かつ効率的に分解でき、ペプチド質量によるデータベース検索が容易になります。 トリプシンとリシルエンドペプチダーゼを併用することにより、リシン残基における切断の確実性が増し、得られるペプチド数が増加します。 和光純薬時報 Vol.78 No.2 p25 (2010.4) Wako Bio Window No.102, p3 (2010.4) 当製品について、当初菌の生理的・形態学的性質から、由来はAchromobacter lyticusと表示させていただいておりましたが、16S rDNAの塩基配列を比較いたしましたところ、Lysobacter属と高いホモロジーが認められました。 |
|---|---|
| 特長 | 1. リシルエンドペプチダーゼは、タンパク質の切断部位を特異的かつ効率的に分解でき、ペプチド質量によるデータベース検索が容易になる。2. リシルエンドペプチダーゼとトリプシンと併用することにより、リシン残基における切断の確実性が増し、得られるペプチド数が増加する。3. 自己消化が非常に少ない。4. 使用量に応じて微量小分けされている。 |
| 用途 | 1.プロテオーム解析でのペプチドの断片化(ゲル内消化など)2.アミノ酸配列決定の際のタンパク質の断片化3.リシル-ペプチドの分解および合成 |
| 使用例 | 微量遠心チューブやピペットは、シリコン化など低吸着処理したものを使用する。染色は、銀染色MSキット(和光コードNo. 299-58901)やネガティブゲル染色MSキット(和光コードNo. 293-57701)等の質量分析用の試薬を使用する。1. タンパク質サンプルを電気泳動により分離する。2. ゲルからタンパク質バンドを切り出し、数片に刻んで微量遠心チューブに入れる。3. ゲル片を脱色する。(脱色は、質量分析用の染色キットに含まれる脱色液を使用する。)4. アセトニトリル300μLを加えて30分間ミキサーで振盪し、脱水する。5. アセトニトリルを捨てて微量遠心チューブの口をパラフィルムで覆う。6. パラフィルムに針で穴を開けたのち、15分間真空乾燥する。7. 100μLの10mmol/L DTTを含む100mmol/L重炭酸アンモニウムで56℃、1時間還元する。8. 室温に冷やした後にDTT溶液を捨てて、同量の50mmol/L ヨードアセトアミドを含む100mmol/L重炭酸アンモニウムに置き換え、45分間暗所で時々振盪する。9. ゲル片を100μLの100mmol/L重炭酸アンモニウムで10分間振盪して洗浄する。10. アセトニトリル300μLで15分間振盪して、脱水する。11. 100μLの100mmol/L重炭酸アンモニウムで15分間振盪して、膨潤させる。12. 再びアセトニトリル300μLで15分振盪して、脱水する。13. 液を捨てて、15分間真空乾燥する。14. 氷上で、酵素液※100μLを加え、45分間静置し、膨潤する。※リシルエンドペプチダーゼは、終濃度が10μg/mLとなるように50mmol/L Tris-HCl, pH8.5で溶解する。15. 酵素液を除き10μLの50 mmol/L Tris-HCl, pH8.5(酵素なし)を加えて、37℃終夜インキュベートする。16. 20mmol/L重炭酸アンモニウム50μLを加え、20分間振盪し、溶液を回収する。17. 5%ギ酸/50%アセトニトリル50μLを加え、20分間振盪し、溶液を回収する(3回繰り返す)。18. 必要に応じてSpeed-Vacなどにより濃縮する。19. Zip-TipRなどで脱塩する。20. 必要であれば、弱い陰圧で2μL程度まで濃縮する。21. マトリックスと混和して質量分析する。 |
物性情報
| 外観 | 凍結乾燥品 |
|---|---|
| 起源 | Bacteria |
| 活性 | 0.03~0.07AU/vial |
| 反応 | タンパク質およびペプチドのリシン残基のカルボキシル基側のペプチド結合(Lys-X)を特異的に切断する。 |
| 溶解性 | 水またはバッファーに溶解 水に溶ける。「溶解性情報」は、最適溶媒が記載されていない場合がございます。 |
| pH情報 | 最適pH:プロテイナーゼ活性:pH8.5~10.7、アミラーゼ活性:pH9.0~9.5、エステラーゼ活性:pH8.0安定pH:4.0~11.0(4℃、24時間) |
| 温度情報 | 最適温度:45℃(Bz-Lys-p-NA,pH9.0) |
| 阻害情報 | 主な阻害剤DEP,PMSF,TLCK,リシン型トリプシンインヒビター、アンモニアおよびアルキルアミン金属イオン(Zn2+,Ba2+,Cs+,Rb+,K+,Na+,Li+) |
「物性情報」は参考情報でございます。規格値を除き、この製品の性能を保証するものではございません。
本製品の品質及び性能については、本品の製品規格書をご確認ください。
なお目的のご研究に対しましては、予備検討を行う事をお勧めします。
製造元情報
別名一覧
- Lys-C
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 製品規格・包装規格の改訂が行われた場合、画像と実際の製品の仕様が異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。