医薬品原料に関する法令・規格等
医薬品に関する法令、告示、通知等としては以下に示すようなものがあります。本コンテンツでは、これらを踏まえて当社の医薬品原料に関連するものとしてGMP、ISO9001、日本薬局方、ICHガイドラインについて紹介します。
医薬品に関する法令等の一部例
| 憲法 | 日本国憲法 |
|---|---|
| 法律 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法) |
| 施行令 | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令(薬機法施行令) |
| 省令・施行規則 |
など |
| 告示 |
など |
| 通知・事務連絡 |
など |
GMP
薬は人々の生命に直接関わるものです。そのため調剤や処方のみならず、医薬品やその原料の製造段階でも適切な管理を行う必要があります。GMPとはGood Manufacturing Practiceの略で、医薬品等の製造における適切な管理を纏めた基準であり、医薬品等の製造業者が守るべきものです。日本では厚生労働省令で医薬品及び医薬部外品の製造管理及び品質管理の基準として定められており、GMP省令と呼ばれています。
薬機法では、医薬品は製造業の許可を受けた者でなければ業として製造をしてはならないこと、その製造所がGMP省令で定める基準に適合していないときは製造業許可を与えないことができるとされています。
当社の医薬品製造用原料CertiProシリーズの製品のうちCertiProに区分される製品は、この医薬品製造業許可を取得した工場で製造し、GMP省令に適合した管理を実施しています。
GMPの三原則
GMPは、次の3つの要件から成り立っています。
1.人為的な誤りを最小限にすること
2.医薬品の汚染及び品質低下を防止すること
3.高い品質を保証するシステムを設計すること
医薬品GMP制定の経緯
1950年~1960年代、世界中で胎児の奇形が数多く報告されました。原因はサリドマイドという鎮静剤を妊婦が妊娠初期に服用したことでした。サリドマイドは成人への副作用が報告されていながら販売が継続され、被害が拡大しました。このいわゆるサリドマイド事件と呼ばれる薬害事件がきっかけとなり、医薬品の安全性に対する要求が高まりました。その後、ヨーロッパ各国や日本でもGMPが法的に整備され、改正を重ねながら運用されています。
ISO9001
ISOとは、International Organization for Standardization(国際標準化機構)の略称です。ISOはスイスに拠点を置く非政府国際機関で、各分野の専門家の知識を収集し、製品の製造やそのプロセス管理、サービスの提供、材料の供給などにおける標準規格を策定しています。これによって消費者が製品等の安全性・信頼性・品質を信用できることを目指しています。
ISO9001とはISOが定めた品質マネジメントに関する規格の一つで、システムの確立・実施・維持・継続的改善に関する要件を規定しています。ISO9001は製造以外にもサービス・医療・教育などのあらゆる業種において世界中で広く活用されています。品質マネジメントを規定するISO9000ファミリーの中で、ISO9001は認証を取得できる唯一の規格です。
当社の医薬品原料CertiPro-L、バイオプロセシング用溶液は、このISO9001認証を取得した工場で製造して、GMP省令に適合した管理はしていないものの、このような国際規格に基づいて適切な管理の下で製造されています※1。
※1 CertiPro-L製品については製造・品質管理などの一部でGMP省令に準じた管理を実施しています。
参考:ISO - International Organization for Standardization(https://www.iso.org/home, 2025年4月参照)
薬局方
薬局方とは、その国で使用される医薬品の品質等に関する基準を示すものです。日本では1886年に、わが国の医薬品の品質を適正に確保するために必要な規格・基準及び標準的試験法等を示す公的な規範書として日本薬局方(JP:Japanese Pharmacopoeia、日局)が施行されました。その後改正が行われ、2023年3月時点では第十八改正薬局方(第一追補含む)が公布されています。日本薬局方に収載されていない成分のうち重要なものについては日本薬局方外医薬品規格(JPC、局外規)に、日本薬局方に収載されていない医薬品添加物については医薬品添加物規格(JPE、薬添規)に規格が定められています。
※当社の試薬サイトへ移動します。
他国の主な薬局方としては米国薬局方(USP)、欧州薬局方(Ph. Eur., EP)、中国薬局方(ChP, CP)、英国薬局方(BP)があります。「日米欧三薬局方検討会議(PDG:Pharmacopoeial Discussion Group)」では薬局方の国際調和が検討されており、第十九改正日本薬局方作成基本方針でも国際化の一層の推進が示されています。国際的に、この日米欧の三薬局方への対応に加え、中国薬局方を加えた4つの薬局方に対応していることが求められつつあります。加えて、2021年にPDGがパイロットプログラムに迎え入れたインド薬局方も注目されています。
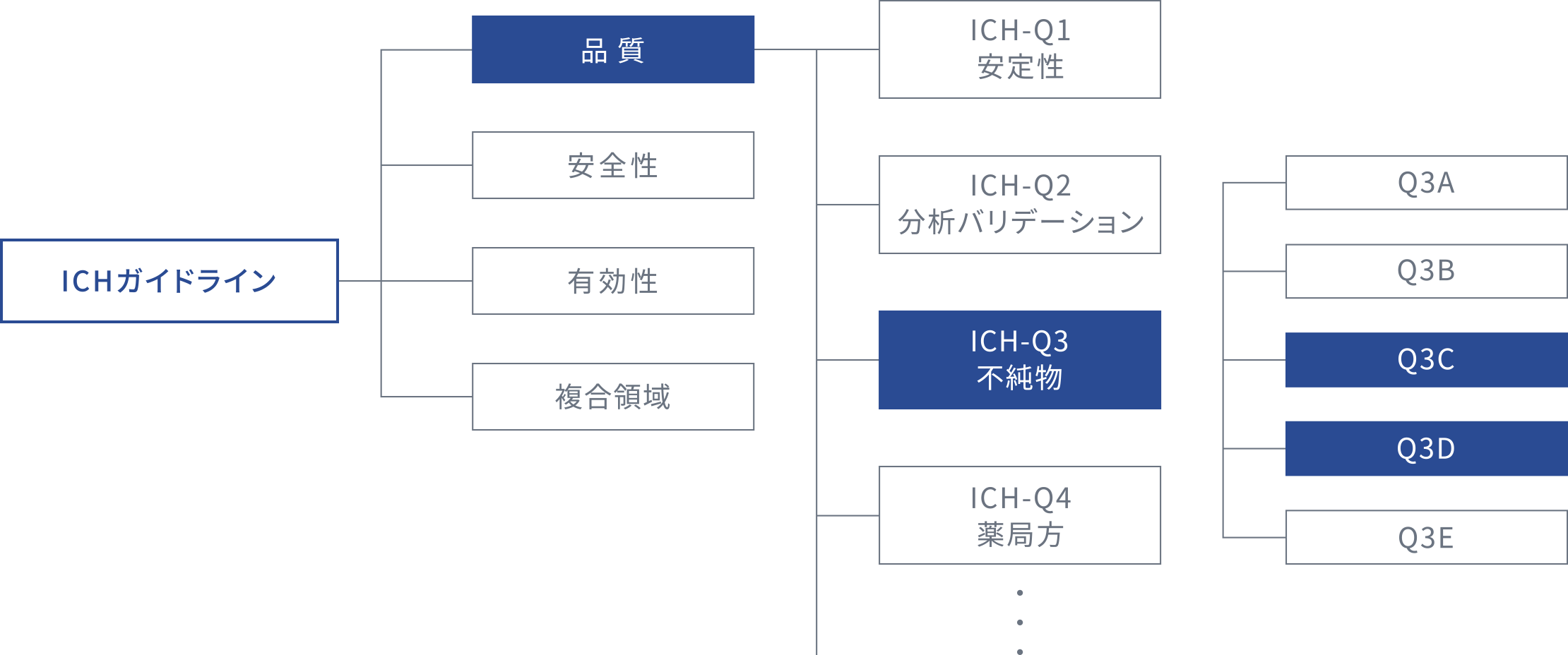
ICHガイドライン
ICHとは医薬品規制調和国際会議(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)の略語で、医薬品規制当局と製薬業界の代表者が協働して、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議です。グローバル化が進む医薬品開発において、安全性、有効性、及び高い品質の医薬品が効率よく確実に開発、認可されるよう、より一層の規制の国際調和を図ることを使命としています。
ICHガイドラインは、品質・安全性・有効性・複合領域に分類され、更に項目ごとに分けられています。例えばICH Q3C「医薬品の残留溶媒ガイドライン」では、患者の安全のために医薬品中の残留溶媒の許容量を勧告することを目的としており、医薬品製造の際には、できるだけ低毒性の溶媒を使用するように勧告するとともに、いくつかの残留溶媒について毒性学的に許容し得る限度値を示しています。
また、第十九改正日本薬局方作成基本方針には「元素不純物の管理について、国際的な動向を踏まえ、日本薬局方への取り組みのロードマップに基づき、その実行に取り組む」と記載されており、ICH Q3D「医薬品の元素不純物管理ガイドライン」を踏まえた元素不純物管理を取り込むことが示されています。