PCR試薬
20世紀終盤以降の生命科学分野の著しい発展は、PCR技術により支えられたといっても過言ではなく、PCR技術の発明者であるキャリー・マリス博士は1993年にノーベル化学賞を受賞しています。PCRの性能は酵素やバッファー条件に依存しており、各社がその技術を競い合っている状況です。当社は高性能のPCR酵素と最適なバッファー条件により実現した高性能PCR試薬を提供しています。
製品ラインアップ
学術コンテンツ
PCRの原理
PCRとは、Polymerase Chain Reactionの略で、DNAポリメラーゼを用いて連鎖反応的にDNAを増幅する方法です。
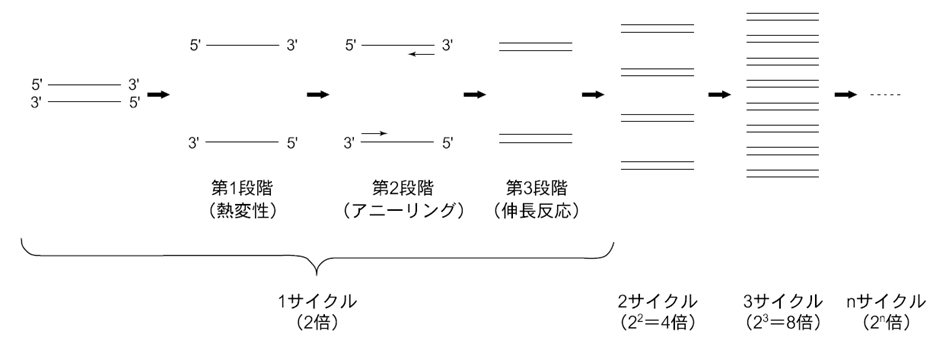
PCRの原理は① 増幅したいDNA、② その両端の配列に相補的な一対のDNAプライマー、③ 耐熱性DNAポリメラーゼを用いて、3段階の温度変化をnサイクル繰り返すことによって標的DNA を2n倍に増幅することにあります。温度変化の第1段階(94~96℃)で、標的二本鎖DNAを熱変性して一本鎖とし、第2段階(55~ 60℃)でプライマーを一本鎖DNAにアニーリングさせ、第3段階(72~74℃)で伸長反応を進めます。1サイクルで標的DNAは2倍になり、理論的にはnサイクルの反応で標的DNAは2n倍に増幅されるので20サイクルでは約100万倍に増幅されることになります(図)。
PCRに影響を与える要因
ここでは一般的なTaq DNA ポリメラーゼを用いた場合、PCRに影響を与える因子を紹介します。
酵素濃度
Taq DNA ポリメラーゼは、通常1~2.5 units/100 μL反応液で使用されます。
一般に濃度が高すぎると非特異的産物が出現することがあり、逆に濃度が低すぎると増幅が不十分になります。
dNTP 濃度
dNTP濃度は通常それぞれ20~200 μmol/Lです。各dNTP の濃度は同一でないと誤った取り込みによるエラーが生じる原因になります。
特異性と忠実度は、dNTP濃度が低いほど高くなります。理論的には、100 μL反応液で20 μmol/Lの各dNTPが存在すれば、2.6 μgのDNAが合成できます。
Mg2+濃度
通常、総dNTP濃度より0.5~2.5 mmol/L高い濃度が採用されます。鋳型DNAやプライマーから持ち込まれるEDTAなどのキレート剤の濃度に注意する必要があります。
プライマー
プライマーは、通常18~28ヌクレオチド長で、G+C 含量が50~60%で、Tm値が55~80℃となるように設計します。
2つのプライマーはそれぞれ0.1~0.5 μmol/Lで使用します。
プライマーの設計上のポイントは以下の通りです。
① 両プライマーのTm値が同程度であること。
② プライマーの3′末端側の塩基配列が正確であること。
③ プライマーの3′末端どうしが相補的でないこと。
④ G+C 含量があまり高くないこと(50~60%がよい)。特にプライマーの3′末端側にG+Cリッチな領域がないようにする。
⑤ プライマー自身がヘアピンのような高次構造をとらないこと。
温度
変性温度は高いほど特異性や増幅度が高くなりますが、逆にTaq DNA ポリメラーゼの活性低下を早めるので、普通は94~96℃で15~30秒間程度です。
プライマーのアニーリング温度は、Tm 値より5℃程低い温度がよく、通常55~60℃です。アニーリング温度が高いほど特異性は高くなります。0.2μmol/Lのプライマーは数秒間でアニーリングします。
伸長反応の温度は、72℃が多く用いられます。合成速度は、他の反応条件にもよりますが、1秒間で35~100ヌクレオチドです。
サイクル数
サイクル数は多いほど増幅度は高くなりますが、同時に非特異的産物が増加します。40サイクルを越えないことが望ましいとされています。理論的には指数関数的に増幅しますが、実際にはプラトーになります。
その他
pHもPCRに影響をおよぼします。通常10~50mmol/L Tris-HCl(pH 8.3 ~ 8.8 at 20℃)が用いられます。
また、塩濃度、ゼラチンや非イオン性界面活性剤の存在によっても影響を受けます。
PCR は非常に高温で反応を行うため、反応液中の水分が蒸発し、組成が変わる可能性があります。反応液にミネラルオイルを重層することにより水分の蒸発を防ぐことができます。(サーマルサイクラーの種類によってはミネラルオイルが必要ないものもあります。)




