同仁化学 オートファジー経路測定キット

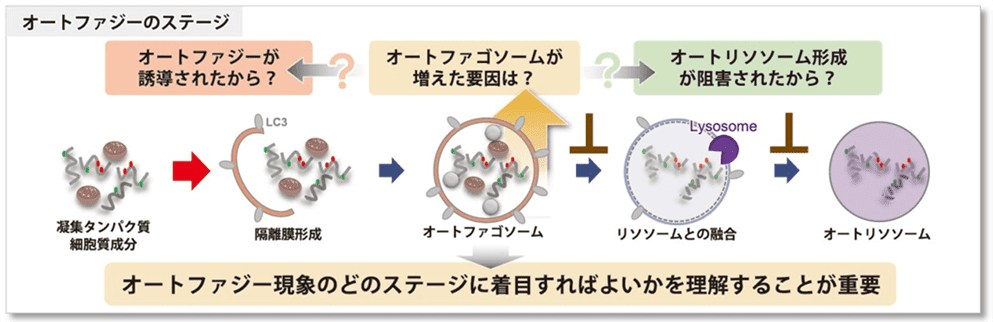
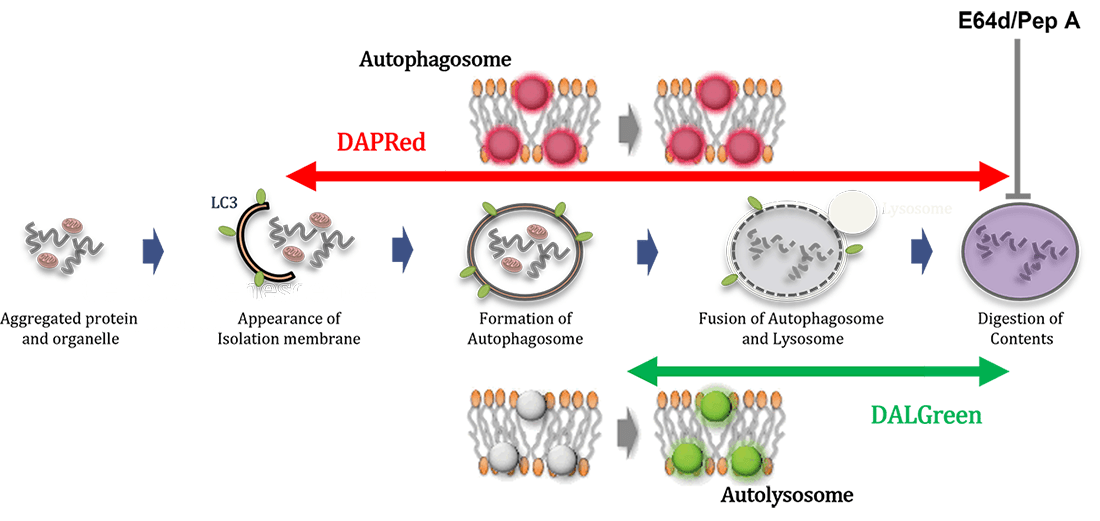
細胞内の不要なタンパク質や細胞小器官を再利用、または代謝するための分解過程であるオートファジーは、パーキンソン病などの神経変性疾患、老化に関わりがあることが分かってきており、盛んに研究されています。近年では、オートファジーを詳細に解析するため、オートファゴソームが増えた要因がオートファジー誘導によるものなのか、またはオートリソソーム阻害によるものなのかを区別する事が求められてきており、オートファジーによる一連の分解の流れ (Flux) を理解することが重要視されています。
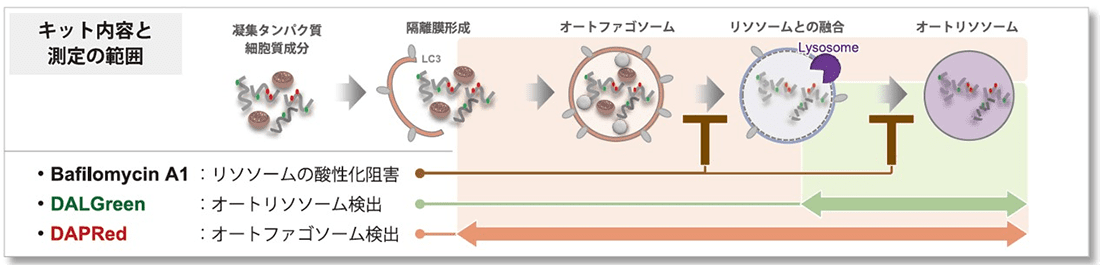
本キットには、オートファゴソームおよびオートリソソームを検出するDAPRedと、オートリソソームを検出するDALGreen、および、リソソーム酸性阻害剤 Bafilomycin A1 (Baf. A1) が同梱されています。オートファジーの形成からオートリソソームの分解までをモニタリングし、オートファジーの活性を正しく評価できます1)。
1) H. Sakurai, et al., "Development of small fluorescent probes for the analysis of autophagykinetics", iScience, 2023, 26, 107218.
特長
- 試薬の添加だけでオートファジー経路を解析できる
- リソソーム酸性化阻害剤同梱のオールインワンキット
<キット内容>
| コンポーネント | 数量 | 備考 |
|---|---|---|
| DAPRed | 1本 | オートファゴソームおよびオートリソソームを検出 |
| DALGreen | 1本 | オートリソソームのみを検出 |
| Bafilomycin A1 | 1本 | リソソーム酸性阻害剤 |
本キットでできること
本キットには、オートファゴソームおよびオートリソソームを検出する DAPRed (DAPRed - Autophagy Detection) と、オートリソソームを検出するDALGreen (DALGreen - Autophagy Detection)、さらにリソソームの酸性化阻害剤 Bafilomycin A1 が同梱されています。試薬の添加だけでオートファゴソーム形成からオートリソソームの形成過程をモニタリングできます2,3)。
2) X. Chen, et al, "Chaiqi decoction ameliorates vascular endothelial injury in metabolic syndrome by upregulating autophagy, Am J Transl Res .,2020, 12(9), 4902-4922.
3) C. Oh, et al, "S-Nitrosylation of p62 Inhibits Autophagic Flux to Promote α-Synuclein Secretion and Spread in Parkinson's Disease and Lewy BodyDementia, J Neurosci., 2022, 42(14), 3011-3024.
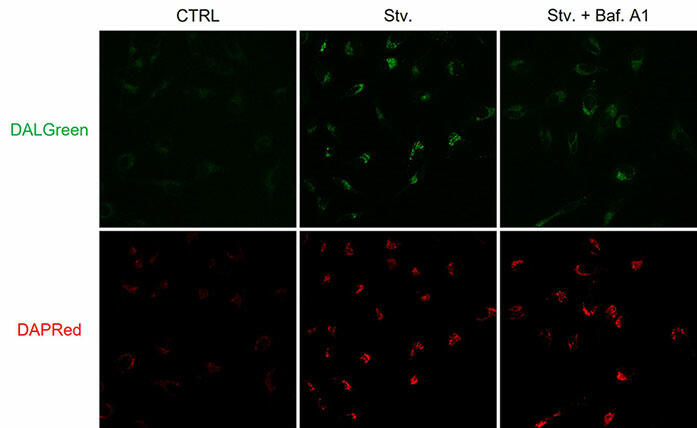
実験例1. 共焦点蛍光顕微鏡を用いたBafilomycin A1によるオートリソソームの形成阻害の解析
HeLa 細胞をリソソーム酸性化阻害剤 Bafilomycin A1 (Baf. A1) で処理した際のDALGreenとDAPRedの変化を検出しました。DALGreen は、Baf. A1 添加に伴うオートリソソームの形成阻害により、飢餓誘導細胞と比較して蛍光の低下が確認されましたが、DAPRedは、Baf. A1 添加に伴うオートファゴソームの蓄積により、飢餓誘導細胞と比較して蛍光の増加が確認されました。
※Baf. A1の希釈倍率、処理時間、添加のタイミングにより、イメージング解析に影響を及ぼす恐れがあります。詳細は「よくある質問」をご参照ください。
| 阻害剤 | DAPRed | DALGreen | 効果(飢餓誘導細胞との比較) |
|---|---|---|---|
| Bafilomycin A1 (リソソーム酸性化阻害剤 ) |
増加↑ or 変化なし | 減少↓ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:減少↓ |
| 3-MA (オートファゴソーム形成阻害剤) |
減少↓ | 減少↓ | オートファゴソーム:減少↓ オートリソソーム:減少↓ |
| E64d/Pepstatin A (リソソームプロテアーゼ阻害剤) |
増加↑ or 変化なし | 増加↑ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:増加↑ |
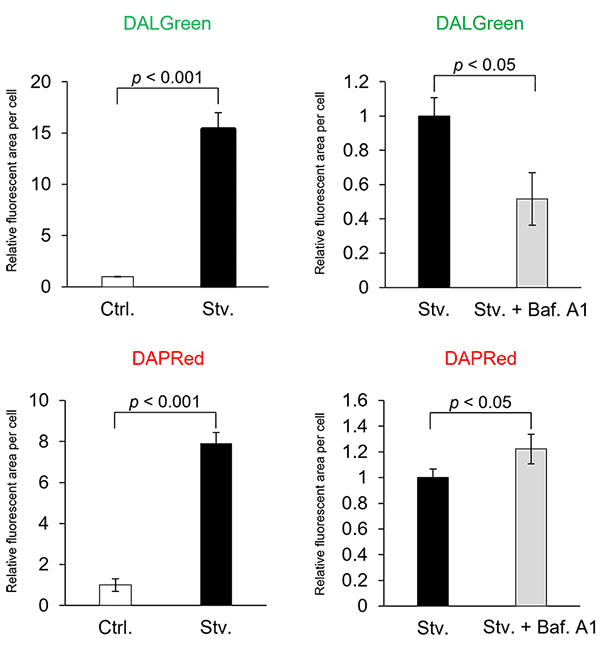
数値化方法:Image Jで蛍光値(area)を取得し一視野あたりの細胞数で補正した*
サンプル数:n=3
<検出条件>
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、Baf. A1: オートリソソーム形成阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)
<実験操作>
- μ-slide 8 well plate (ibidi社) に HeLa 細胞 (1.0 x 104 cells/well) を播種し、5% CO2 存在下、37℃ で一晩培養した。
- 10% FBS 含有 MEM 培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) を well に 200 μl 加え、 5% CO2 存在下、 37℃で30分インキュベートした。
- 上澄みを取り除き、細胞を 10% FBS 含有 MEM 培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS含有 MEM 培地を well に200 μl加え、 5% CO2 存在下、 37℃ で2時間20分インキュベートした。(コントロール条件)
- アミノ酸不含培地 (富士フイルム和光純薬、製品コード: 048-33575) を well に 200 μl 加え、 5% CO2 存在下、 37℃で2時間20分インキュベートした。(飢餓誘導条件)
- アミノ酸不含培地を well に 200 μl 加え、 5% CO2 存在下、 37℃で2時間インキュベートした。上澄みを取り除き、Bafilomycin A1 working solution (リソソーム酸性化阻害剤) (2000 倍希釈) を well に 200 μl 加え、 5% CO2 存在下、 37℃で20分インキュベートした。(オートリソソーム形成阻害条件)
- 共焦点蛍光顕微鏡で観察した。
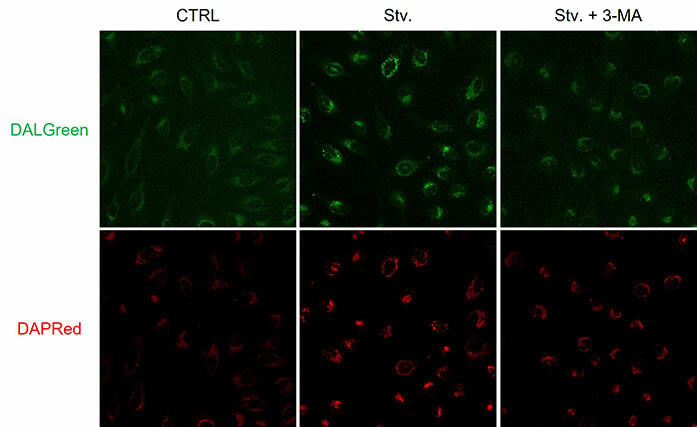
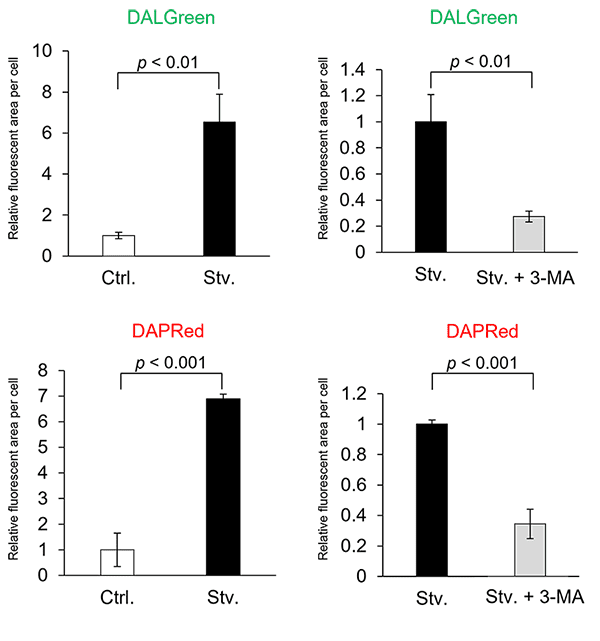
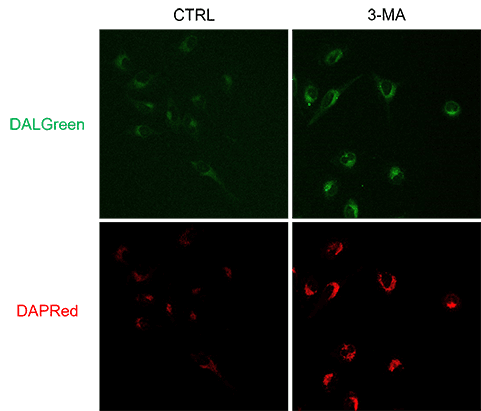
実験例2. 共焦点蛍光顕微鏡を用いた3-MAによるオートファゴソームの形成阻害の解析
HeLa 細胞をオートファジー阻害剤 3-MAで処理した際のDALGreenとDAPRedの変化を検出しました。DALGreen、DAPRed ともに、3-MA 添加に伴うオートファゴソームの形成阻害により、飢餓誘導細胞と比較して蛍光の低下が確認されました。
※3-MA の処理時間、添加のタイミングにより、オートファジーへの影響が変化する恐れがあります。詳細は「よくある質問」をご参照ください。
| 阻害剤 | DAPRed | DALGreen | 効果(飢餓誘導細胞との比較) |
|---|---|---|---|
| Bafilomycin A1 (リソソーム酸性化阻害剤 ) |
増加↑ or 変化なし | 減少↓ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:減少↓ |
| 3-MA (オートファゴソーム形成阻害剤) |
減少↓ | 減少↓ | オートファゴソーム:減少↓ オートリソソーム:減少↓ |
| E64d/Pepstatin A (リソソームプロテアーゼ阻害剤) |
増加↑ or 変化なし | 増加↑ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:増加↑ |
数値化方法:Image Jで蛍光値(area)を取得し一視野あたりの細胞数で補正した*
サンプル数:n=3
<検出条件>
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、3-MA: オートファゴソーム形成阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)
<実験操作>
- μ-slide 8 well plate (ibidi社) にHeLa 細胞 (1.0 x 104 cells/well) を播種し、5% CO2 存在下、37℃ で一晩培養した。
- 10% FBS 含有 MEM 培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) を well に200 μl加え、37℃で30分インキュベートした。
- 上澄みを取り除き、細胞を 10% FBS 含有 MEM 培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS 含有 MEM 培地を well に 200 μl 加え、 5% CO2 存在下、 37℃で2時間20分インキュベートした。(コントロール条件)
- アミノ酸不含培地 (富士フイルム和光純薬、製品コード: 048-33575) を well に 200 μl 加え、 5% CO2 存在下、 37℃で2時間20分インキュベートした。(飢餓誘導条件)
- アミノ酸不含培地を well に 200 μl 加え、 5% CO2 存在下、 37℃で2時間インキュベートした。上澄みを取り除き、アミノ酸不含培地で調製した 3-MA (オートファジー阻害剤) (10 mmol/l) を well に 200 μl 加え、 5% CO2 存在下、 37℃ で20分インキュベートした。(オートファゴソーム形成阻害条件)
- 共焦点蛍光顕微鏡で観察した。
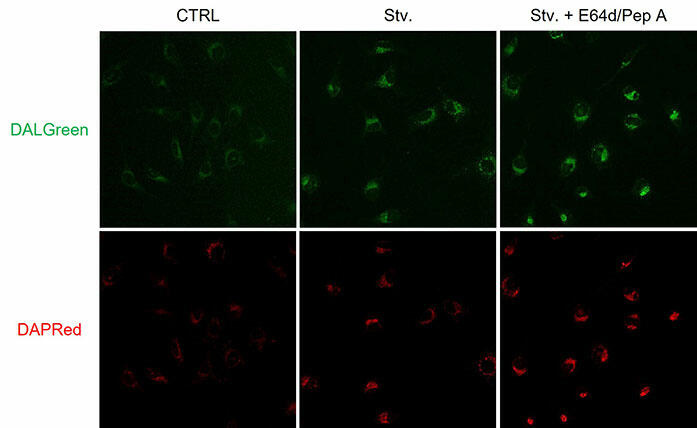
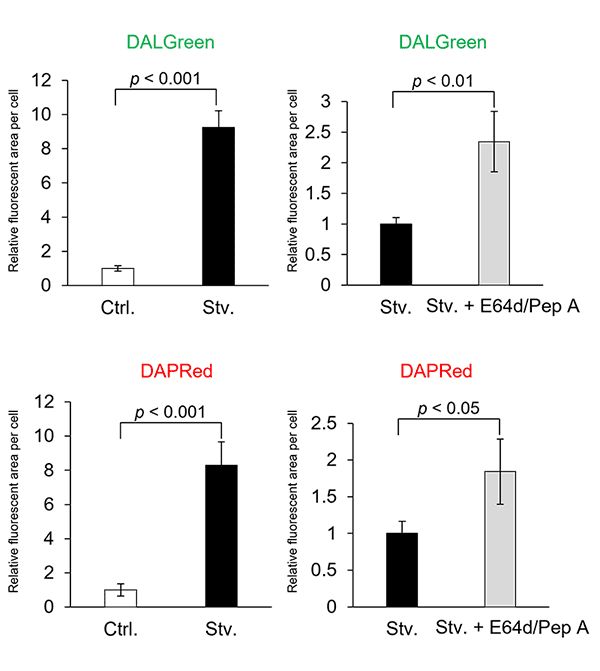
実験例3. 共焦点蛍光顕微鏡を用いたE64d/Pepstatin Aによるリソソーム内分解阻害の解析
HeLa 細胞をリソソームプロテアーゼ阻害剤 E64d/Pepstatin A (Pep A) で処理した際の DALGreen と DAPRed の変化を検出しました。E64d/pepstatin A 添加に伴うリソソーム内分解阻害によりオートリソソームが蓄積し、飢餓誘導単独と比較して DALGreen、DAPRed 共に蛍光の増加が確認されました。
| 阻害剤 | DAPRed | DALGreen | 効果(飢餓誘導細胞との比較) |
|---|---|---|---|
| Bafilomycin A1 (リソソーム酸性化阻害剤 ) |
増加↑ or 変化なし | 減少↓ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:減少↓ |
| 3-MA (オートファゴソーム形成阻害剤) |
減少↓ | 減少↓ | オートファゴソーム:減少↓ オートリソソーム:減少↓ |
| E64d/Pepstatin A (リソソームプロテアーゼ阻害剤) |
増加↑ or 変化なし | 増加↑ | オートファゴソーム:増加↑ or 変化なし オートリソソーム:増加↑ |
<検出条件>
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、E64d/pepstatin A:リソソーム内分解阻害阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)
<実験操作>
- μ-slide 8 well plate (ibidi社) に HeLa 細胞 (1.0 x 104 cells/well) を播種し、5% CO2 存在下、37℃で一晩培養した。
- 10% FBS 含有 MEM 培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) を well に 200 μl 加え、37℃ で30分インキュベートした。
- 上澄みを取り除き、細胞を 10% FBS 含有 MEM 培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS 含有 MEM 培地を well に 200 μl 加え、 5% CO2 存在下、 37℃ で2時間インキュベートした。(コントロール条件)
- アミノ酸不含培地 (富士フイルム和光純薬、製品コード: 048-33575) を well に200 μl加え、 5% CO2存在下、 37℃で2時間インキュベートした。(飢餓誘導条件)
- アミノ酸不含培地で調製したE64d/Pep A (リソソームプロテアーゼ阻害剤) (それぞれ10 µg/ml) を well に 200 μl 加え、 5% CO2存在下、 37℃で2時間インキュベートした。(リソソーム内分解阻害条件)
- 共焦点蛍光顕微鏡で観察した。
オートファジー検出試薬の比較表
オートファジー検出用のキット・試薬をラインナップしております。試薬を単品で使用する場合は、蛍光顕微鏡だけでなくフローサイトメーターでも検出できます。またDAPGreenは、プレートリーダーによる検出も可能です。ご研究の目的やご使用の装置に併せてお選びください。
| 測定対象 | 製品名(品コード) | 蛍光特性 | 対応装置 | 容量・使用回数の目安 | |||
|---|---|---|---|---|---|---|---|
| 蛍光顕微鏡 | FCM | プレート リーダー |
|||||
| オートファジー経路 | 【本製品】 Autophagic Flux Assay Kit(A562) |
DALGreen: λex=350-450 nm λem=500-560 nm ※ 共焦点顕微鏡では 488 nmにて励起可能 |
〇 | ✕※1 | ✕ | 1 set | 35 mmdish 5枚 μSlide 8well 5枚 96-well Plate 1枚 [染色濃度1.0μmol/l(DALGreen), 0.2μmol/l(DAPRed)の場合] |
| DAPRed: λex=500-560 nm λem=690-750 nm |
|||||||
| オートリソソーム | DALGreen - Autophagy Detection (D675) | λex=350-450 nm λem=500-560 nm ※ 共焦点顕微鏡では 488 nmにて励起可能 |
〇 | 〇 | ✕ | 20 nmol | 35 mmdish 10枚 μSlide 8well 10枚 96-well Plate 2枚 [染色濃度1.0μmol/lの場合] |
| オートファゴソーム | DAPRed - Autophagy Detection (D677) | λex=500-560 nm λem=690-750 nm |
〇 | ✕ | ✕ | 5 nmol | 35 mmdish 25枚 μSlide 8well 25枚 96-well Plate 5枚 [染色濃度0.1μmol/l(DAPRed,DAPGreen), の場合] |
| オートファゴソーム | DAPGreen - Autophagy Detection (D676) | λex=425-475 nm λem=500-560 nm ※ 共焦点顕微鏡では 488 nmにて励起可能 |
〇 | 〇 | 〇 | 5 nmol | |
※ DALGreenとDAPGreenの共染色はできません。
※ 使用回数は染色濃度により異なります。
スペクトルデータ
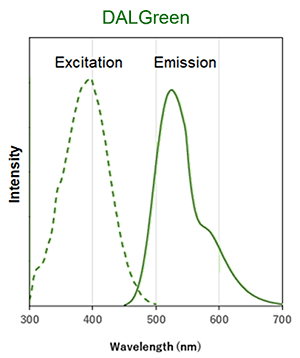
λex: 405 nm
λem: 525 nm
<観察条件>
Ex : 488 nm
Em : 500-560 nm
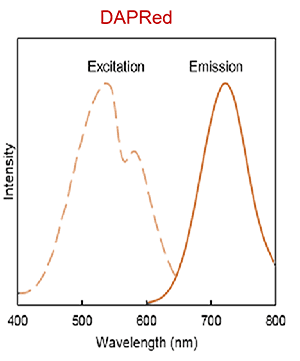
λex: 530 nm
λem: 720 nm
<観察条件>
Ex : 561 nm
Em : 565–700 nm
参考文献
| 文献No. | 対象 サンプル |
引用(リンク) |
|---|---|---|
| 1) | 細胞 (HeLa, MEFs) |
H. Sakurai, et al, "Development of small fluorescent probes for the analysis of autophagy kinetics, iScience, 2023, 26, 107218. |
| 2) | 細胞 (HUVECs) |
X. Chen, et al, "Chaiqi decoction ameliorates vascular endothelial injury in metabolic syndrome by upregulating autophagy, Am J Transl Res., 2020, 12(9), 4902-4922. |
| 3) | 細胞 (SH-SY5Y) |
C. Oh, et al, "S-Nitrosylation of p62 Inhibits Autophagic Flux to Promote α-Synuclein Secretion and Spread in Parkinson's Disease and Lewy Body Dementia, J Neurosci., 2022, 42(14), 3011-3024. |
よくある質問
- DALGreen/DAPRed Working solution は、どのくらい安定ですか?
-
DALGreen/DAPRed Working solution の保存はできません。用時調製してください。
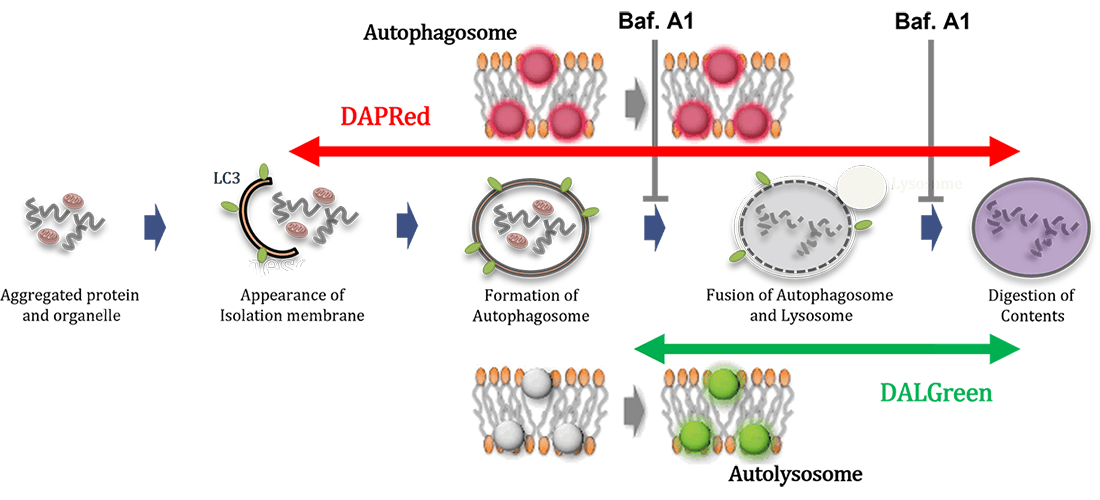
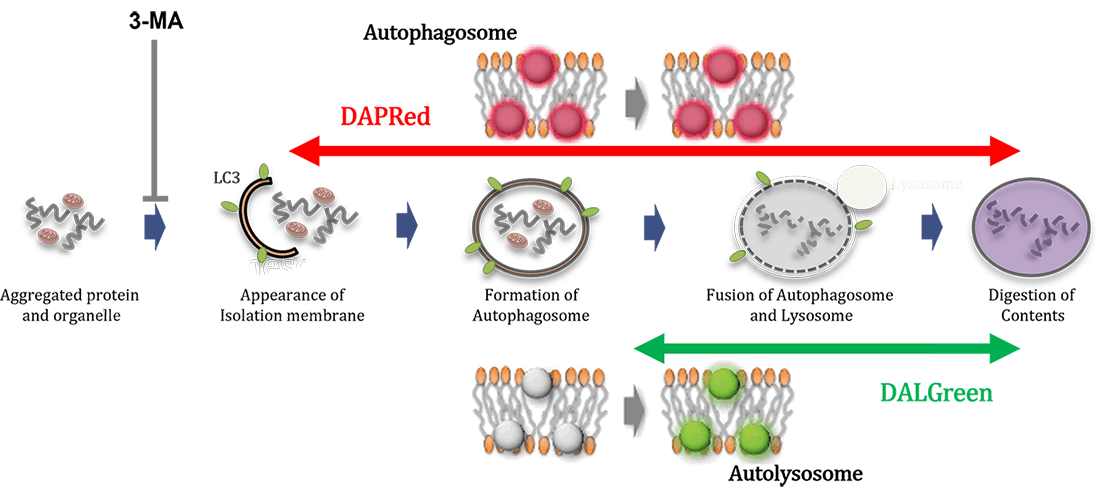
- オートファジーにはどのような経路があり、 DALGreen、DAPRed はどの状態を検出するのですか?
-
オートファジーには、Atg5 依存的オートファジー (LC3 が変化する) と LC3 の変化を伴わない、Atg5 非依存的オートファジーがあることが知られております*。DALGreen はオートファゴソーム膜に取り込まれ、その後、リソソームと融合し酸性環境下で蛍光が増大します。そのため、DALGreen はオートリソソームの状態を検出します。DAPRed はオートファゴソーム膜に取り込まれ疎水環境下で蛍光を発し、オートファゴソームからオートリソソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
https://www.dojindo.co.jp/letterj/160/review/01.html
- 1キットあたり使用回数の目安を教えてください。
-
測定可能なサンプル数は以下をご参考ください。
・ 35 mm dish:5枚、μ-Slide 8 well:5 枚、96-well Plate:1 枚
※DALGreen/DAPRed working solution の最終濃度がそれぞれ DALGreen : 1.0 µmol/l、DAPRed: 0.2 µmol/l で使用した場合。
- オートリソソームの形成阻害実験で、Baf. A1の処理について注意点はありますか?
-
長時間のBaf. A1処理により、イメージング解析においてDAPRed蛍光シグナルが拡散し蛍光総量(area)に変化がないにも関わらず蛍光輝度が下がっているようにみえる場合があります。短時間の処理ではこのような変化は認められないため、プロトコルに従って2時間の飢餓誘導後に短時間(20 – 40 分)Baf. A1処理をしてください。長時間のBaf. A1処理 (8時間) で数値解析したDAPRedの蛍光総量 (area) が変わらないことは確認しております。
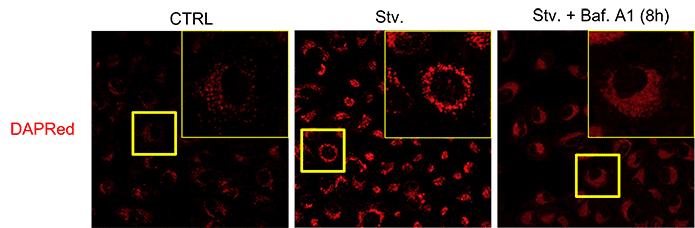
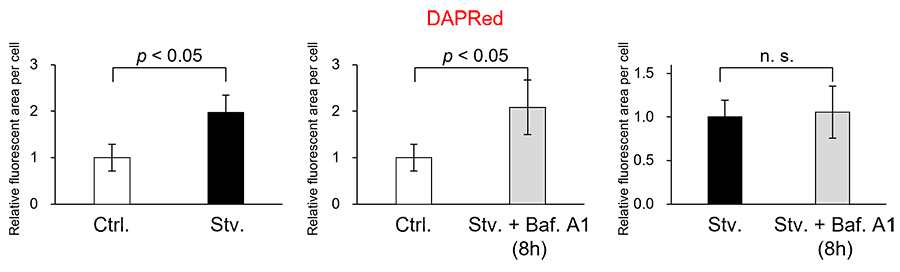
数値化方法:Image Jで蛍光値(area)を取得し一視野あたりの細胞数で補正した*
サンプル数:n=3*一視野当たりの細胞数をできるだけそろえてイメージング画像を取得して下さい。<検出条件>
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、Baf. A1: オートリソソーム形成阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)<実験操作>
- μ-slide 8 well plate (ibidi社) にHeLa細胞 (1.0 x 104 cells/well) を播種し、5% CO2 存在下、37℃で一晩培養した。
- 10% FBS 含有 MEM 培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) をwellに200 μl加え、37℃で30分インキュベートした。
- 上澄みを取り除き、細胞を 10% FBS含有 MEM 培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS 含有 MEM 培地を well に 200 μl 加え、 5% CO2存在下、 37℃で8時間インキュベートした。(コントロール条件)
- アミノ酸不含培地 (富士フイルム和光純薬、製品コード: 048-33575) を well に200 μl加え、 5% CO2 存在下、 37℃で8時間インキュベートした。(飢餓誘導条件)
- アミノ酸不含培地で希釈した Bafilomycin A1 (Baf. A1: リソソーム酸性化阻害剤) (10,000倍希釈) を well に 200 μl 加え、 5% CO2 存在下、 37℃で8時間インキュベートした。(オートリソソーム形成阻害条件)
- 共焦点蛍光顕微鏡で観察した。
- オートファゴソームの形成阻害の実験で、3-MAの処理について注意点はありますか?
-
長時間の 3-MA 処理により、オートファジーを促進してしまうことが報告されています*。また、3-MA 処理 (計90分) を行った後に2時間培養した細胞において、コントロール細胞と比較して DAPRed および DALGreen のシグナルが増加し、オートファジーが誘導されたことを確認した実績がございます。短時間の処理ではオートファジーの阻害に働くため、プロトコルに従って2時間の飢餓誘導後に20分程度の短時間で 3-MA 処理を行ってください。
*D. Klionsky et. Al., "Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)“, Autophagy, 2016.12(1), 1–222.
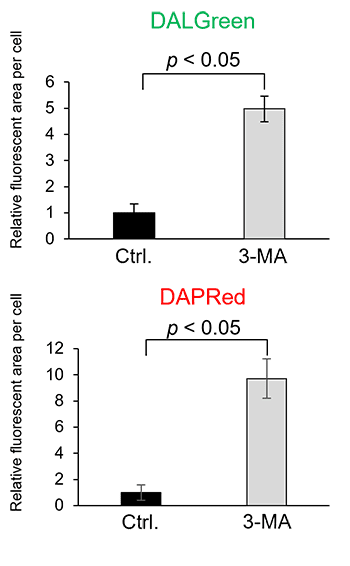
数値化方法:Image Jで蛍光値(area)を取得し、一視野あたりの細胞数で補正した*
サンプル数:n=3*一視野当たりの細胞数をできるだけそろえてイメージング画像を取得して下さい。<検出条件>
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、3-MA: オートファゴソーム阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)<実験操作>
- μ-slide 8 well plate (ibidi社) に HeLa 細胞 (1.0 x 104 cells/well) を播種し、5% CO2 存在下、37℃で一晩培養した。
- 上澄みを取り除き、細胞を 10% FBS 含有 MEM 培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS 含有 MEM 培地を well に 200 μl 加え、 5% CO2存在下、 37℃ で1時間インキュベートした。 10% FBS 含有 MEM 培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) を well に200 μl加え、37℃で30分インキュベートした。(コントロール条件)
- 10% FBS 含有 MEM 培地で調製した 3-MA (10 mM) を well に 200 μl 加え、 5% CO2 存在下、 37℃で1時間インキュベートした。 10% FBS含有MEM培地で2回洗浄後、10 mM 3-MA を含む DALGreen/DAPRed working solution (DALGreen: 1 µM、DAPRed: 0.2 µM) を well に 200 μl 加え、37℃で30分インキュベートした。(3-MA処理条件)
- 上澄みを取り除き、細胞を 10% FBS 含有 MEM 培地で2回洗浄した。
- 10% FBS含有 MEM 培地を wellに 200 μl 加え、 5% CO2 存在下、 37℃で2時間インキュベートした。
- 共焦点蛍光顕微鏡で観察した。
- 使用実績のあるオートファジー誘導剤と阻害剤を教えてください。
-
下記の誘導剤と阻害剤の使用実績があります。
細胞 薬剤 阻害/誘導 効果 濃度 処理時間 処理方法 蛍光総量の変化 HeLa
A549
HepG2Bafilomycin A1 阻害剤 オートリソソーム形成阻害 2,000倍希釈 20分 飢餓誘導後
*アミノ酸不含培地DALGreen ↓
DAPRed ↑ or →
*飢餓誘導単独と比較してHeLa 3-MA 阻害剤 オートファゴソーム形成阻害 10 mM 20分 飢餓誘導後
*アミノ酸不含培地DALGreen ↓
DAPRed ↓
*飢餓誘導単独と比較してHeLa E64d/pepstatin A 阻害剤 リソソームプロテアーゼ阻害 それぞれ
10 µg/ml2時間 飢餓誘導と同時
*アミノ酸不含培地DALGreen ↑
DAPRed ↑
*飢餓誘導単独と比較してHeLa Rapamycin 誘導剤 オートファジー誘導 1 µM 24時間 培養培地 DALGreen ↑
DAPRed ↑
*コントロールと比較して
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



