Polysciences社 レクチン結合ビーズ
本製品は磁気ビーズの表面に植物レクチンであるWGAやConcanavalin Aが結合しています。本製品を使用することで、各レクチンが認識する糖鎖を持つ細胞などを精製することが可能となります。
製品概要
本製品は表面に植物レクチンであるWGAやConcanavalin Aが結合した磁気ビーズです。
各レクチンは以下の糖鎖を認識します。本製品を使用することで細胞上清や細胞破砕液中の下記糖鎖タンパク質などを精製することが可能となります。
WGA ・・・ N-アセチルグルコサミン (GlcNAc)
Concanavalin A ・・・ マンノース (Man)、グルコース (Glu)
必要な材料
WGA
【提供される材料】
- BioMag®Plus Wheat Germ Agglutinin 3mL もしくは 10mL
(組成:WGA coated particles in 10mM PBS with BSA + 0.075% NaN3 + 0.004% EDTA)
【本製品の他に必要な材料】
- マイクロチューブ
- 哺乳類血清 0.4mLをPBSで1/20希釈したもの
- Binding Buffer 組成:1x PBS + 0.1% NaN3 + 1 mM MgCl2 + 1 mM MnCl2 + 1 mM CaCl2 (pH 7.4)
- Wash Buffer組成:1x PBS + 0.1% NaN3 + 1 mM MgCl2 + 1 mM MnCl2 + 1 mM CaCl2 (pH 7.4) + 0.1% Tween®20
- WGA particle Elution Buffer 組成:10mM Tris (pH 8.0) + 0.15 M NaCl + 0.1% SDS + 0.2 M N-acetyl glucosamine
- チューブ遠心機
- ボルテックスミキサー
- ローテーター
- マグネティックセパレーター
Concanavalin A
【提供される材料】
- BioMag®Plus Concanavalin A 3mL もしくは 10mL
(組成:Con A coated particles in 10mM PBS with 0.1% sodium azide)
【本製品の他に必要な材料】
- マイクロチューブ
- 哺乳類血清 0.4mLをPBSで1/20希釈したもの
- Binding Buffer 組成:1x PBS + 0.1% NaN3 + 1 mM MgCl2 + 1 mM MnCl2 + 1 mM CaCl2 (pH 7.4)
- Wash Buffer組成:1x PBS + 0.1% NaN3 + 1 mM MgCl2 + 1 mM MnCl2 + 1 mM CaCl2 (pH 7.4) + 0.1% Tween®20
- Con A particle Elution Buffer 組成:5mM Tris (pH 8.0) + 0.15M NaCl + 0.05% SDS + 1M Glucose
- チューブ遠心機
- ボルテックスミキサー
- ローテーター
- マグネティックセパレーター
WGAプロトコール
本プロトコールは例ですので実験に合わせて最適化をお願いいたします。
- ① 10mMのPBSで1/20で希釈した0.4mLのサンプル(血清など)を用意します。
- ② 1mLのWGAビーズを新しいマイクロチューブに入れ、マグネティックセパレーターに移します。ビーズを磁気で分離し、溶液を除きます。
- ③ 1mLのBinding Bufferを加えビーズを洗浄します。
- ④ ③の操作を繰り返し、上清を除きます。
- ⑤ ①のサンプルに0.1mLのBinding Bufferを加え、④のマイクロチューブにサンプルを加えます。その後ボルテックスや転倒混和をします。
- ⑥ マイクロチューブをローテ―ターに移し、10分間します。
- ⑦ マイクロチューブをローテーターからマグネティックセパレーターに移し、上清を除きます。
- ⑧ 0.5mLのWash Bufferを加え、ボルテックスや転倒混和します。
- ⑨ ⑦~⑧の操作を繰り返し0.5mLのWash Bufferを加えたのちにローテ―ターで5分間混和します。
- ⑩ ⑦~⑨の操作を繰り返します。
- ⑪ マイクロチューブをローテ―ターからマグネティックセパレーターに移し上清を除きます。
- ⑫ マイクロチューブに250µLのElution Bufferを加え、ローテ―ターで10分間混和します。
- ⑬ マイクロチューブをローテ―ターからマグネティックセパレーターに移し、溶出液を除き新しいマイクロチューブに移します。
- ⑭ ⑫~⑬の操作を繰り返し、溶出液を⑬のマイクロチューブに集めます。
Con Aプロトコール
本プロトコールは例ですので実験に合わせて最適化をお願いいたします。
- ① 10mMのPBSで1/20で希釈した0.4mLのサンプル(血清など)を用意します。
- ② 1mLのConAビーズを新しいマイクロチューブに入れ、マグネティックセパレーターに移します。ビーズを磁気で分離し、溶液を除きます。
- ③ 1mLのBinding Bufferを加えビーズを洗浄します。
- ④ ③の操作を繰り返し、上清を除きます。
- ⑤ ①のサンプルに0.1mLのBinding Bufferを加え、④のマイクロチューブにサンプルを加えます。その後ボルテックスや転倒混和します。
- ⑥ マイクロチューブをローテ―ターに移し、10分間混和します。
- ⑦ マイクロチューブをローテーターからマグネティックセパレーターに移し、上清を除きます。
- ⑧ 0.5mLのWash Bufferを加え、ボルテックスや転倒混和します。
- ⑨ ⑦~⑧の操作を繰り返し0.5mLのWash Bufferを加えたのちにローテ―ターで5分間混和します。
- ⑩ ⑦~⑨の操作を繰り返します。
- ⑪ マイクロチューブをローテ―ターからマグネティックセパレーターに移し上清を除きます。
- ⑫ マイクロチューブに250µLのElution Bufferを加え、ローテ―ターで10分間混和します。
- ⑬ マイクロチューブをローテ―ターからマグネティックセパレーターに移し、溶出液を除き新しいマイクロチューブに移します。
- ⑭ ⑫~⑬の操作を繰り返し、溶出液を⑬のマイクロチューブに集めます。
データ例
WGA
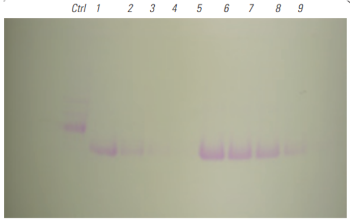
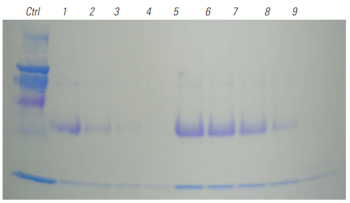
4-20% Tris Glycine SDS-PAGEゲル電気泳動を行った。Lane5~9は様々な量のWGAビーズを使って精製を行った。Glycoprotein staining kitで糖タンパク質の染色(左図)とCBB染色(右図)を行った。
Lane番号
- 滴定トリプシン阻害剤コントロール
- 滴定トリプシン阻害剤コントロール
- 滴定トリプシン阻害剤コントロール
- 滴定トリプシン阻害剤コントロール
- トリプシン阻害剤溶出液 (WGAビーズ 1mL)
- トリプシン阻害剤溶出液 (WGAビーズ 0.75mL)
- トリプシン阻害剤溶出液 (WGAビーズ 0.5mL)
- トリプシン阻害剤溶出液 (WGAビーズ 0.25mL)
- トリプシン阻害剤溶出液 (WGAビーズ 0.1mL)
BioMag®Plus Wheat Germ Agglutininを量依存的に使用することで糖タンパク質を精製することができた。
Con A
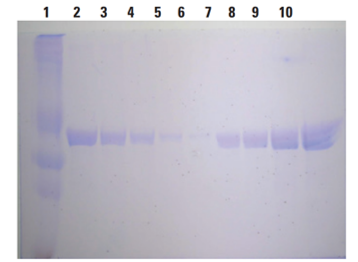
Apo-transferrinタンパク質のサンプルを様々な量のBioMag®Plus Concanavalin Aで溶出した(Lane2~6)。0.3mg/mLのApo-transferrin溶液と比較した(Lane7~10)。
Lane番号
- マーカー
- Con Aビーズ 1mL
- Con Aビーズ 0.5mL
- Con Aビーズ 0.25mL
- Con Aビーズ 0.125mL
- Con Aビーズ 0.05mL
- Apo-Transferrin
- Apo-Transferrin
- Apo-Transferrin
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。