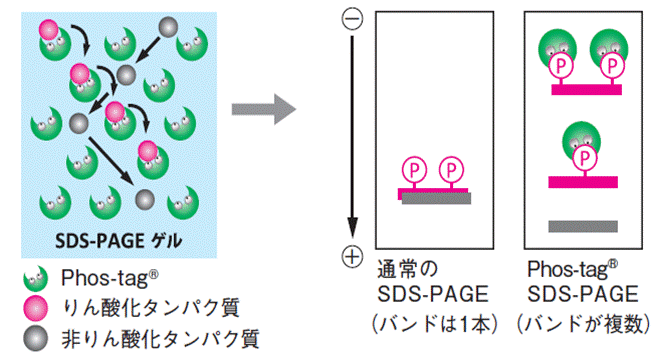
スーパーセップ™ Phos-tag®
Phos-tag®アクリルアミドを共重合させたプレキャストゲルです。開封後すぐにご使用いただけます。本製品を使用することでりん酸化タンパク質をりん酸化レベルに応じて分離できます。また従来のSuperSep™同様に中性ゲルバッファーを採用しているため保存安定性に優れており、シャープなバンドが得られます。
- 本製品を使用する前に通常のSDS-PAGEで泳動パターンに問題がないことを確認してください(アプライ量が適切か、目的タンパク質が分解されていないか、等)。
比較データの取得には同じアクリルアミド濃度のスーパーセップ™をおすすめいたします(参照:使用例)。
特長
- Ready-to-use 貴重な時間を節約
- りん酸化タンパク質をりん酸化レベルに応じて分離
- 分離がよくバンドがシャープ
使用例
アルブミンの脱りん酸化
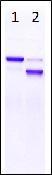
〔泳動用緩衝液〕トリス-グリシン-SDS泳動緩衝液
〔泳動用試料〕
レーン1:未処理アルブミン
レーン2:脱りん酸化アルブミン
〔泳動条件〕20 mA、70分
〔染色法〕クイックCBB染色
〔脱色〕脱イオン水
アルブミン(製品コード 010-17071)をアルカリホスファターゼ(ニッポンジーン社 製品コード 319-02661)を用いて脱りん酸化処理を行った。その結果、バンドシフトにより脱りん酸化が確認できた。
β-caseinの経時的脱りん酸化
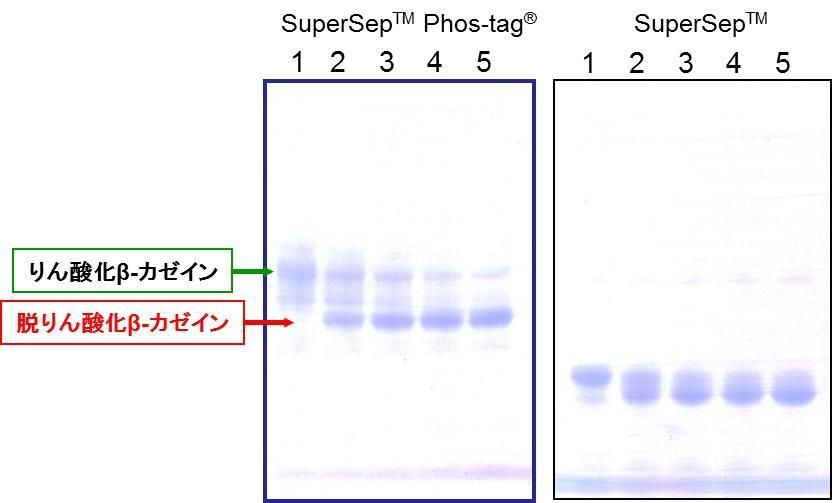
〔泳動用緩衝液〕
トリス-グリシン-SDS泳動緩衝液
〔泳動用試料〕
レーン1:β-カゼイン(AP処理, 0分)
レーン2:β-カゼイン(AP処理, 15分)
レーン3:β-カゼイン(AP処理, 30分)
レーン4:β-カゼイン(AP処理, 45分)
レーン5:β-カゼイン(AP処理, 60分)
〔泳動条件〕35mA、60分
〔染色法〕クイックCBB染色
〔脱色〕脱イオン水
β-カゼインを経時的に脱りん酸化処理を行った。その結果、りん酸化/脱りん酸化β-カゼインの分離が確認できた。また、経時的な脱りん酸化レベルの確認ができた。
りん酸化状態の経時変化
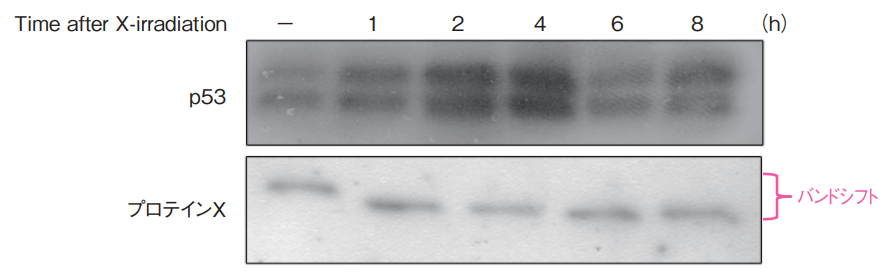
方法
ヒト肺ガン由来Lu99細胞にX線(5Gy)を照射し、経時的に細胞を回収した。細胞抽出液を調製し、スーパーセップ™ Phos-tag® (50 μmol/L), 10 %, 13ウェルを用いてSDS-PAGEを行った。
ゲルを10 mmol/L EDTAを含むトランスファーバッファーで振とう後、PVDF膜へ転写した。メンブレンは、2 %Milk/TBS-Tでブロッキングした後、一次抗体と反応させた(上段:p53, 下段:細胞周期関連タンパク質)。検出は化学発光試薬を用いて行った。
結果
p53は、X線照射により、タンパク質の蓄積が4時間後をピークに見られた。プロテインXは、X線照射により、りん酸化の状態が変化することがわかった。
コントロールタンパク質の泳動
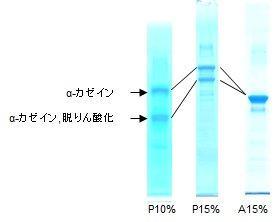
P10 %(左) : スーパーセップ™Phos-tag® (50 μmol/L), 10 %, 13ウェル
P15 %(中) : スーパーセップ™Phos-tag® (50 μmol/L), 15 %, 13ウェル
A15 %(右) : スーパーセップ™エース, 15 %, 13ウェル
泳動条件
30mA/ゲル(定電流), 60分
サンプル
5 μg/lane α-カゼイン, ウシ乳由来, 脱りん酸化(製品コード 038-23221)
- 本製品は脱りん酸化されていないα-カゼインが含まれています。通常のSDS-PAGEでは1本のメインバンドが見られますが、Phos-tag SDS-PAGEではα-カゼインとα-カゼイン, 脱りん酸化の2本のメインバンドが見られます。
ランニングバッファー
SDS-PAGE バッファー, pH8.5(製品コード 192-16801)
染色
クイックCBBプラス(製品コード 174-00553)
電気泳動装置別 ゲル対応表
Bio-Rad社 Mini-PROTEAN® Tetra Cell (メーカーコード: 1658004JA)
| コードNo. | 対応ゲル |
|---|---|
| 198-17981 | SuperSep™ Phos-tag™ (50μmol/L), 7.5%, 17well, 83×100×3.9mm |
| 195-17991 | SuperSep™ Phos-tag™ (50μmol/L), 12.5%, 17well, 83×100×3.9mm |
Thermo Fisher Scientific社 Invitrogen® XCell SureLock™ Mini-Cell (メーカーコード: EI0001)
| コードNo. | 対応ゲル |
|---|---|
| 192-18001 | SuperSep™ Phos-tag™ (50μmol/L), 7.5%, 17well, 100×100×6.6mm |
| 199-18011 | SuperSep™ Phos-tag™ (50μmol/L), 12.5%, 17well, 100×100×6.6mm |
富士フイルム和光純薬 イージーセパレーター™
| コードNo. | 対応ゲル |
|---|---|
| 192-17401 | SuperSep™ Phos-tag™ (50μmol/L), 6%, 13well |
| 199-17391 | SuperSep™ Phos-tag™ (50μmol/L), 6%, 17well |
| 195-17371 | SuperSep™ Phos-tag™ (50μmol/L), 7.5%, 13well |
| 192-17381 | SuperSep™ Phos-tag™ (50μmol/L), 7.5%, 17well |
| 193-16711 | SuperSep™ Phos-tag™ (50μmol/L), 10%, 13well |
| 190-16721 | SuperSep™ Phos-tag™ (50μmol/L), 10%, 17well |
| 195-16391 | SuperSep™ Phos-tag™ (50μmol/L), 12.5%, 13well |
| 193-16571 | SuperSep™ Phos-tag™ (50μmol/L), 12.5%, 17well |
| 193-16691 | SuperSep™ Phos-tag™ (50μmol/L), 15%, 13well |
| 196-16701 | SuperSep™ Phos-tag™ (50μmol/L), 15%, 17well |
※ 記載の社名、ブランド名および製品名は各社の商標もしくは登録商標です。
Q&A
Q1. ゲル染色法は何が使用できますか?
CBB染色、ネガティブ染色、銀染色、蛍光染色など通常使用される染色法で問題ありません。
Q2. CBB染色後の色抜けが悪い。
脱色時に電子レンジを使用することできれいに色抜けします。
処理法
脱イオン水100 mLに染色ゲルを移し、丸めたキムワイプを数枚入れ、電子レンジにセットし数分間加熱処理をしてください。脱イオン水を換え同様の操作を3~4回繰り返してください。熱くなるので注意してください。
Q3. ウエスタンブロットに使用できますか?
使用できます。ただし、メンブレンへの転写効率が悪いためEDTA処理によりゲル中の亜鉛を取り除く必要があります。
処理法
10 mmol/L EDTAを含む転写バッファー(25 mmol/L Tris, 192 mmol/L Glycine, 10% MeOH)に浸し、10分間ゆっくり振とうしてください。同様の操作を3回行ってください。その後、EDTAを含まない転写バッファー(25 mmol/L Tris, 192 mmol/L Glycine, 10% MeOH)で10分間振とう後、PVDFメンブレンまたはニトロセルロースメンブレンへ転写してください。転写効率が悪い場合はEDTA処理回数を増やす、EDTA濃度を上げるなど転写条件をご検討ください。
Q4. バンドが歪んでしまう。
EDTA、無機塩類、界面活性剤などを含むサンプルはバンドの歪み、テーリングの原因となります。そのため、サンプルはTCA沈殿や透析で脱塩してください。また空レーンがある場合も歪みの原因となるため空レーンに試料用緩衝液(x1)をアプライしてください。
Q5. 目的とするタンパク質のりん酸化、非りん酸化が分離されていない。
ポジティブコントロールとしてβ-カゼイン、ネガティブコントロールとしてアルカリホスファターゼ処理したβ-カゼインを泳動しバンドシフトが起きているか確認してください。バンドシフトが確認できた場合、本製品のPhos-tag®濃度もしくはアクリルアミド濃度では目的タ ンパク質のりん酸化、非りん酸化が分離できていない場合があります。
Q6. 細胞粗抽出液を使用することはできますか?
使用できます。ただし、目的とするタンパク質によってはRf値が小さくバンドの分離が不明瞭になる可能性があります。
Q7. 1ウェルあたりにアプライするサンプル量は?
精製タンパク質の場合:1 - 5 μg(CBB染色の場合)、組織・細胞抽出液の場合:10 - 30 μg(発現タンパク量に合わせて調整してください。)
- 目安の値ですので、必ず事前に通常のSDS-PAGE、Western Blotを行い適切なサンプル量を検討してください。
Q8. 分子量マーカーは何を使用すればいいですか。
推奨のマーカーはありません。本製品ではマーカーの分子量が反映されません。そのため、マーカーの代わりにネガティブコントロールとして大腸菌由来の組換えタンパク質または脱りん酸化処理したサンプルを推奨いたします。
Q9. 本品中の錯体イオンは何ですか?
亜鉛イオンです。
Q10. バンドシフトがりん酸化によるものか判別する方法は?
ゲル濃度が同濃度の12.5 % SuperSep™Ace(製品コード 199-14971)で電気泳動を行い、目的タンパク質が分解されていないか確認してください。
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。






