ビットキット-融解液 NX
凍結保存用培地
カタログ番号90179-WK,90180-WK,90181-WK
ビットキット-融解液 NX
Vit Kit-Warm NX
- ・卵子(MⅡ期)および全ステージの胚のビトリフィケーション用凍結培地。
- ・CSCM(ヒト胚用シングルステップ培地)およびMHM(二重緩衝剤)の組成をベースとして使用。

優れたビトリフィケーションを可能にする培地
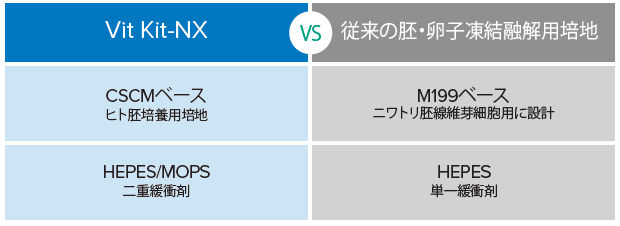
従来の多くのビトリフィケーションキットは、ニワトリ胚線維芽細胞用として設計されたM199 を基礎培地として採用しており、単一緩衝剤を使用しています。この基礎培地をヒト胚用にし、二重緩衝剤を採用することで、胚の高い生存率が期待できます。
また、Vit Kit-NXは、従来のVit Kit 製品のうち、 以下の特徴を継承しています。
- DMSOおよびエチレングリコール(浸透性抗凍結剤)
- DSS代替血清
- ゲンタマイシン(抗生物質)
胚・卵子のストレスを低減するコンティニュアスシステム

Vit Kit-NX、CSCM(ヒト胚培養用培地) および、MHM(体外操作用培地) を組み合わせて使用することで、IVFの 各ステージでもたらされる、大切な 胚・卵子への培地環境変化による ストレスを低減します。
-
-
- 使用目的
- 卵子(MⅡ期)および全ステージのビトリフィケーション胚(2PN~胚盤胞)の融解
-
- 構成および組成
-
Thawing Solution-TS液(黄キャップ) 2ml x 5本
1.0 M Trehalose
20% (v/v) Dextran Serum Supplement※
HEPES/MOPS buffered CSCM
Gentamicin Sufatee
Dilution Solution-DS液(橙キャップ) 1ml x 5本
0.5 M Trehalose
20% (v/v) Dextran Serum Supplement※
HEPES/MOPS buffered CSCM
Gentamicin Sufate
Washing Solution-WS液(赤キャップ) 1ml x 5本
20% (v/v) Dextran Serum Supplement※
HEPES/MOPS buffered CSCM
Gentamicin Sufate
※Dextran Serum Supplement(DSS)
ヒト血清アルブミン(HSA)治療用グレード 50mg/ml
Dextran 20mg/ml
フェノールレッド不含
-
- 品質確認試験
- ロットごとに、pH、 Osmolality、Endotoxin、Mouse Embryo Assay(1cell)、無菌性およびアルブミンについて試験される。
-
- 保存温度
- 2-8℃
-
- 有効期間
- 製造日から1年間(未開封)
開封後2週間
-
-
-
- 使用上の注意
-
異物の混在や溶液に濁りがみられた場合には使用しないこと。
Gentamicinに対するアナフィラキシーを引き起こす可能性のある場合には使用しないこと。
ヒト由来成分が含まれており感染の可能性が完全に否定されたものではないので感染防止の処置をとること。
現在の研究論文は、ビトリフィケーションが胚に及ぼす長期にわたる影響は不明であると示唆している。
※現時点において感染性が皆無であることを検出する方法はない。したがって使用にあたっては感染の可能性が完全に否定されたものではないので感染防止の措置をとること。
-
- 操作時の留意点
-
本製品使用における詳細については、それぞれのラボが、手技およびプロトコルを至適化することが望ましい。
バイアルごと室温に戻すことを避けること。必要量を取った後直ちにバイアルを2-8℃に戻す。
TS液以降の操作は、室温(22-27℃)で処理すること。
加温ステージを使用しないこと。
可能な限り光への暴露を少なくすること。
-
- 参照文献
-
- 1. Kuwayama M, Vajta G, Kato O, Liebo SP. Highly efficient vitrification of human oocytes. RBM Online 11:300-308, 2005.
- 2. Stehlik E, Stehlik J, Katayama KP, Kuwayama M, Jambor V, Brohammer R, Kato O. Vitrification demonstrates significant improvement versus slow freezing of human blastocysts. RBM Online 11:53-57, 2005.
- 3. Takahashi K, Mukaida T, Goto T, Oka C. Perinatal outcome of blastocyst transfer with vitrification using cryoloop: a 4-year follow-up study. Fertil Steril 84:88-92, 2005.
- 4. Kuwayama M, Vajta G, Ieda S, Kato O. Comparison of open and closed methods for vitrification of human embryos and the elimination of potential contamination. RBM Online 11:608-614, 2005.
- 5. Cremades N, Sousa M, Silva J, Viana P, Sousa S, Oliveira C, Teixeira de Silva J, Barros A. Experimental vitrification of human compacted morulae and early blastocysts using fine diameter plastic micropipettes. Human Reproduction 19, 300-305,2004.
- 6. Mukaida T, Nakamura S, Tomiyama T, Wasa S, Oka C, Kasai M, Takahashi K. Vitrification of human blastocysts using cryoloops: clinical outcome of 223 cycles. Hum Reprod 18:384-391, 2003.
- 7. Yoon TK, Kim TJ, Park SE, Hong SW, Ko JJ, Chung HM, Cha KY. Live births after vitrification of oocytes in a stimulated in vitro fertilization- embryo transfer program. Fertil Steril 79:1323-1326, 2003.
- 8. Mukaida T, Takahashi K, Kasai M. Blastocyst cryopreservation: ultrarapid vitrification using cryoloop technique. RBM Online 6: 221-225, 2002.
- 9. Yokota Y, Sato S, Yokota M, Ishikawa Y, Makita M, Asada T, and Araki Y. Successful pregnancy following blastocyst vitrification. Hum. Reprod. 15:1802-1803, 2000.
- 10. Yoon TK, Chung HM, Lim JM, Han SE, Ko JJ, and Cha KY. Pregnancy and delivery of healthy infants developed from vitrified oocytes in a stimulated in vitro fertilization-embryo transfer program. Fertil. Steril. 74:180-181, 2000.
- 11. Chen S-U, Lien Y-R, Cheng Y-Y, Chen H-F, Ho H-N and Yang Y-S. Vitrification of mouse oocytes using closed pulled straws (CPS) achieves a high survival and preserves good patterns of meitic spindles, compared with conventional straws, open pulled straws (OPS) and grids. Hum. Reprod. 16: 2350-2356, 2001.
- 12. Isanchenko V, Selman H, Isachenko E, Montag M, El-Danasouri I, and Nawroth F. Modified vitrification of human pronuclear oocytes: efficacy and effect on ultrastructure. Reproductive BioMedicine Online 7,211-216, 2003.
- 13. Van den Abbeel E, Camus M, Van Waesberghe L, Devroey P, Van Steirteghem AC. A randomized comparison of the cryopreservation of one-cell human embryos with a slow controlled-rate cooling procedure or a rapid cooling procedure by direct plunging into liquid nitrogen. Hum. Reprod. 12:1554-1560, 1997.
- 14. Walker DL, Tummon IS, Hammitt DG, Session DR, Dumesic DA, Thornhill AR. Vitrification versus programmable rate freezing of late stage murine embryos: a randomized comparison prior to application in clinical IVF. Reprod. BioMed Online 8: 558-568, 2004.
- 15. Kasai M. Vitrification: a refined strategy for the preservation of mammalian embryos. [Review] J. Mamm. Ova Res., 14:17-28, 1997.
- 16. Ohta N, Nohara M and Kojimahara T. Ultrarapid freezing of human embryos by vitrification method, A case of delivery. Jpn. J. Fertil. Steril. 41:276-279, 1996.
- 17. Feichtinger W, Hochfellner C, and Ferst C. Clinical experience with ultra-rapid freezing of embryos. Hum. Reprod., 6:735-736, 1991.
- 18. Rall WF. Factors affecting the survival of mouse embryos cryopreserved by vitrification. Cryobiology 24:387-402, 1987.
- 19. Rall WF, Fahy GM. Ice-free cryopreservation of mouse embryos at ‒196°C by vitrification. Nature 313:573-575,1985.
-



