TissuSpec™ Human Fibrotic dECM Coating Kit

よりヒトの生体内に近い細胞培養環境をお手元に。
本製品はヒトの正常/疾患 組織から細胞外マトリックス (ECM) 成分を抽出・試薬化した製品です。細胞培養時に本製品を足場材としてご使用いただくことで、よりヒトの生体内に近い細胞培養環境をin-vitroに再現出来ます。
細胞外マトリックス (ECM) は、臓器/組織ごとに構成する分子・組成が異なっており、細胞の増殖・遊走・遺伝子発現などに大きな影響を与えています。したがって細胞が本来あるべき機能を発現するためには、細胞ごとに適切なECMを選択することが必要です。
また近年、各組織に特異的なECMが、各種細胞 (がん細胞を含む) の薬剤感受性に大きな影響を与えることが報告されていることからも、創薬研究における細胞ベースアッセイを用いた新薬候補物質評価などでは、この影響を無視することが出来なくなっています。
今回、新たにヒト由来組織ECM試薬としてTissueSpec™ Human Fibrotic dECM Coating Kitがラインアップに加わり、更にヒトの生体内に近い細胞環境をご提供することが可能となりました。
- 使用法やプロコトルはメーカーホームページより入手してください。製品には付属していません。
- 製品の品質試験項目についてはCOA(参考例)をご参照ください(予告なく変更となる場合があります。最新の情報につきましてはお問い合わせください)。
製品ラインアップ
| Human Fibrotic dECM Coating Kit (2D) | ||
|---|---|---|
| 肺 |  |
TissueSpec™ Human Lung Fibrotic dECM Coating Kit (MTHDLG201) |
| 肝臓 |  |
TissueSpec™ Human Liver Fibrotic dECM Coating Kit (MTHDLV201) |
ヒト線維化肺組織由来細胞外基質
特発性肺線維症 (IPF) を含む、ヒトの線維化した肺より抽出されたECM試薬は、生体内環境を生理的に模倣 (physiomimetic approach) することで、既存のECM試薬よりも遥かに優れたヒト線維化肺環境をin-vitroに再現し、線維化肺特有の疾患モデリングおよび医薬品開発を強力に支援します。
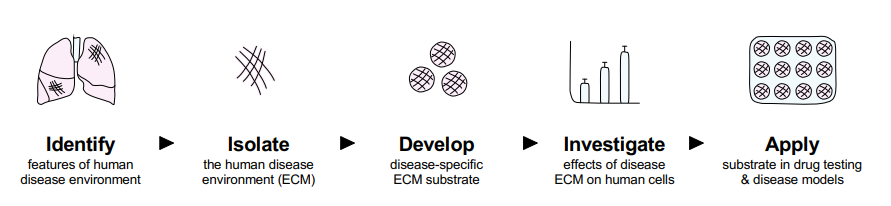
Fig.1 | Overview of physiomimetic approach. (Germanguz et al., 2019)
Our development of IPF disease-specific cell culture substrates is guided by a physiomimetic approach that aims to identify and isolate the human disease environment, then develop and investigate disease-specific ECM substrates in vitro utilizing disease-relevant human cell types (e.g., pulmonary fibroblasts) whose phenotype can be directly compared against diseased human IPF lung specimens prior to application in IPF disease models and antifibrotic drug testing.特発性肺線維症 (IPF)
特発性肺線維症 (IPF) は、原因不明な間質性肺炎の一種です。IPFは、繰り返し損傷を受けた肺胞(肺実質)の修復のためにコラーゲン線維などが蓄積することで間質組織が厚くなり、呼吸機能の進行性喪失などの肺機能障害を引き起こします。IPFは世界中で約300万人もの患者がいると推定されており、米国だけで年間死亡者は40,000人を超えています。既存治療薬であるニンテダニブとピルフェニドンは、IPFの進行を遅らせますが、根本的に治すことは出来ず、肺移植以外の効果的な治療法の開発が急務となっています。
現状の線維化肺モデルの課題
IPFを含む間質性肺疾患は、既存の動物モデルやin-vitroモデルではヒトの生体内疾患環境を十分に再現できていないため、 IPFの効果的な治療法を開発する上での大きな障害となっています。例えば、肺線維症の動物モデルはげっ歯類で報告がありますが1-3)、ヒトのIPFに特徴的な進行性の非分解性線維化プロセスではなく、時間の経過とともに分解する分解性線維症を示します4,5)。 一方、現在のin-vitroのIPFモデルは、線維化したヒト肺の複雑な生化学的、構造的、および機械的環境を再現できていません。線維症では、細胞外マトリックス (ECM) が、正常時とは異なる生化学的組成を持ち、線維形成に関与する成長因子をより多く保持しています。また、正常時のECM 6-8)と比較して構造と力学特性の変化が認められ、成長因子の直接的な影響9,10)が増大します。このようなECMの変化は、線維化を促進する微小環境の形成に関与し、肺線維芽細胞を活性化することから、IPFの進行が異常なECM微小環境と相関していることを示唆するとの報告もあります 11)。
正常肺組織とIPF肺組織の違い
IPF患者の肺組織では、健常者と比較して、コラーゲン線維などの結合性線維が異常に蓄積していることはよく知られています。一方、結合性線維の他にも、ECMを構成する様々な生化学的因子の様態が異なっています。例えば、IPF肺組織と正常な肺組織をアルシアンブルー染色 (Fig.2A) およびペンタクローム染色 (Fig.2B) したところ、IPF肺組織においてはプロテオグリカンが多量に発現していることが示唆されました。
硫酸化グリコサミノグリカン (GAG) の定量測定でも、IPF患者の肺組織およびECMでは、健常者のものより明らかな上昇が確認されました (Fig.2C,D,E)。これは、線維性病巣では硫酸化グリコサミノグリカンが過剰発現するという先行研究での報告内容と一致するものです12)。
また、IPF組織の免疫化学染色からも、ECMを構成する複数の糖タンパク質 (fibrillin 2, laminin γ1, Matrix GLA Protein (MGP), periostin) において、正常な肺組織とは劇的な違いが明らかになりました (Fig.2F,G,H,I,J)。
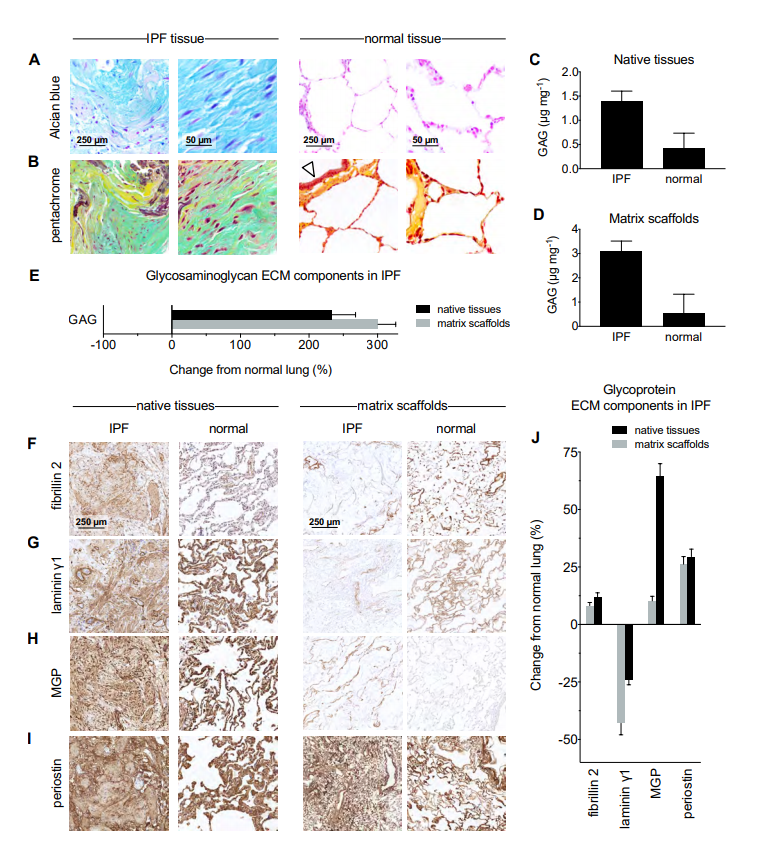
Fig.2 | Characterization of proteoglycans and glycoproteins in IPF lung tissues and matrix scaffolds. (Germanguz et al., 2019)
Representative micrographs of histologic stains: (A) Alcian blue (proteoglycans, blue) and (B) pentachrome (acidic polysaccharides, green) demonstrating differences in proteoglycans between IPF and normal lung tissues. Arrow indicates normal airway epithelium. Quantification of sulfated glycosaminoglycan ECM components in (C) native tissues and (D) matrix scaffolds. (E) Changes from normal lung in glycosaminoglycan ECM components in IPF. Immunohistochemical staining of glycoprotein ECM components in IPF: (F) fibrillin 2, (G) laminin γ1, (H) matrix gla protein (MGP), (I) periostin. (J) Quantification of glycoproteins by image analysis of immunohistochemical staining using DensitoQuant software.IPF患者肺組織を構成するマトリックス成分の質量分析結果からも、先述の組織学的観察や生化学的分析の結果と相関したマトリックス組成の変化が確認されました。例えば、IPF患者の肺組織マトリックスにおけるI, II, V, VI, VIII, XVI型コラーゲンの含量は、健常者のそれらよりも150%以上増加していました。注目すべきは、肺胞基底膜を構成する主要な成分であるIV型コラーゲン量が、健常者に比べ大きく減少していたことです。この結果は肺線維症の進行に伴う肺胞構造の喪失と一致するものです。
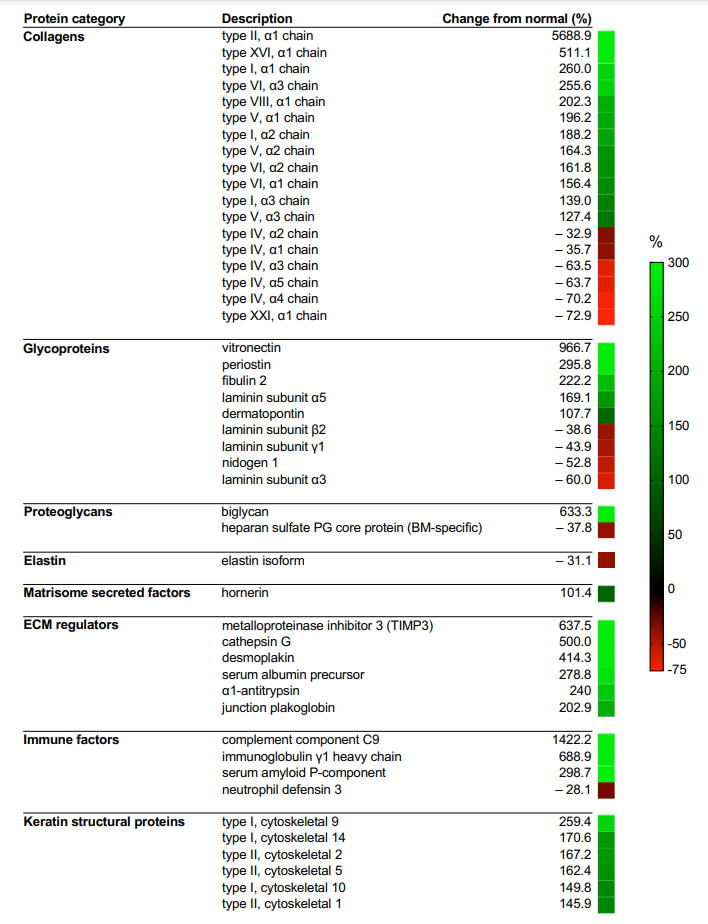
Table 1 | Mass spectrometry summary analysis of IPF lung matrisome. (Germanguz et al., 2019)
Changes from normal in the abundance of IPF lung matrisome components. PG: proteoglycan, BM: basement membrane,Reference.
- Moore BB, Hogaboam CM. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 2008;294(2):L152-60.
- Mouratis MA, Aidinis V. Modeling pulmonary fibrosis with bleomycin. Curr Opin Pulm Med. 2011;17(5):355-61.
- Antje Moeller JCRL, Lingqiao Wang, Jack Gauldie, Martin Kolb. Models of pulmonary fibrosis. Drug Discovery Today Disease Models. 2006;3:243-9.
- Noble PW, Barkauskas CE, Jiang D. Pulmonary fibrosis: patterns and perpetrators. J Clin Invest. 2012;122(8):2756-62.
- Moore B, Lawson WE, Oury TD, Sisson TH, Raghavendran K, Hogaboam CM. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 2013;49(2):167-79.
- Zhou Y, Horowitz JC, Naba A, Ambalavanan N, Atabai K, Balestrini J, et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biol. 2018;73:77-104.
- Shimbori C, Gauldie J, Kolb M. Extracellular matrix microenvironment contributes actively to pulmonary fibrosis. Curr Opin Pulm Med. 2013;19(5):446-52.
- Kristensen JH, Karsdal MA, Genovese F, Johnson S, Svensson B, Jacobsen S, et al. The role of extracellular matrix quality in pulmonary fibrosis. Respiration. 2014;88(6):487-99.
- Hetzel M, Bachem M, Anders D, Trischler G, Faehling M. Different effects of growth factors on proliferation and matrix production of normal and fibrotic human lung fibroblasts. Lung. 2005;183(4):225-37.
- Correll KA, Edeen KE, Redente EF, Zemans RL, Edelman BL, Danhorn T, et al. TGF beta inhibits HGF, FGF7, and FGF10 expression in normal and IPF lung fibroblasts. Physiol Rep. 2018;6(16):e13794.
- Wight TN, Potter-Perigo S. The extracellular matrix: an active or passive player in fibrosis? Am J Physiol Gastrointest Liver Physiol. 2011;301(6):950-5.
- Lu J, Auduong L, White ES, Yue X. Up-regulation of heparan sulfate 6-O-sulfation in idiopathic pulmonary fibrosis. Am J Respir Cell Mol Biol. 2004;50(1):106-114.
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
ヒト組織由来/溶液タイプの試薬 / 2D培養向け
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



