ディールス・アルダー反応
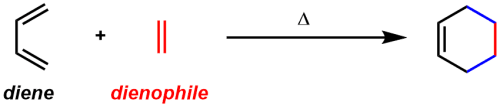
[4+2]環化付加反応の代表的な反応です。諸々の共役ジエンと親ジエンからシクロヘキセン骨格が得られます。一般に良好な立体選択性・位置選択性にて進みます。
環状化合物、特に6員炭素環の合成戦略ではほぼFirst Choiceとして用いられます。数ある反応の中でも実用性は群を抜いています。
ジエンまたは求ジエンのいずれかもしくは両方が安定な場合には、熱的に逆反応が起こりえます。これをretro Diels-Alder反応とよびます。ヘテロ原子(窒素、酸素など)を環内に含む場合はヘテロDiels-Alder反応と呼びます。また光学活性な化合物を得る手法である不斉Diels-Alder反応も良く研究されています。
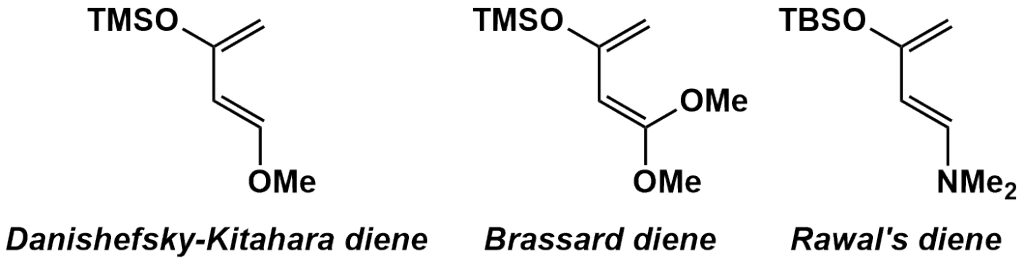
Danishefsky-Kitahara dieneと呼ばれるジエンは、単純ジエンに比して位置選択性や反応性に優れています。このため、合成上有用な試薬として汎用されます。類似のものとしてBrassard diene、Rawal dieneが知られています。
本反応の開発における業績により、Otto DielsとKurt Alder両名は1950年のノーベル化学賞を受賞しています。
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。
Chem-Stationについて
反応機構
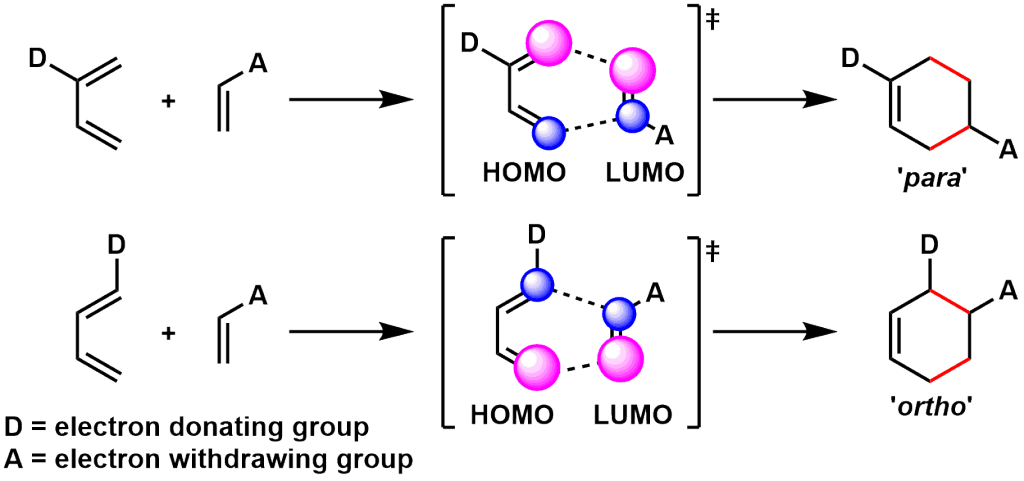
通常、dieneに電子供与基(EDG)、dienophilieに電子求引基(EWG)を持つ基質が反応に用いられます。フロンティア軌道(dieneのHOMOとdienophilieのLUMO)のエネルギー差が小さくなるため、軌道相互作用による安定化が効果的になり、反応が進行しやすくなります(通常電子要請型)。同様の考え方によれば、dienophileに電子供与基、dieneに電子求引基を持つものも反応しやすいと言えます(逆電子要請型)。

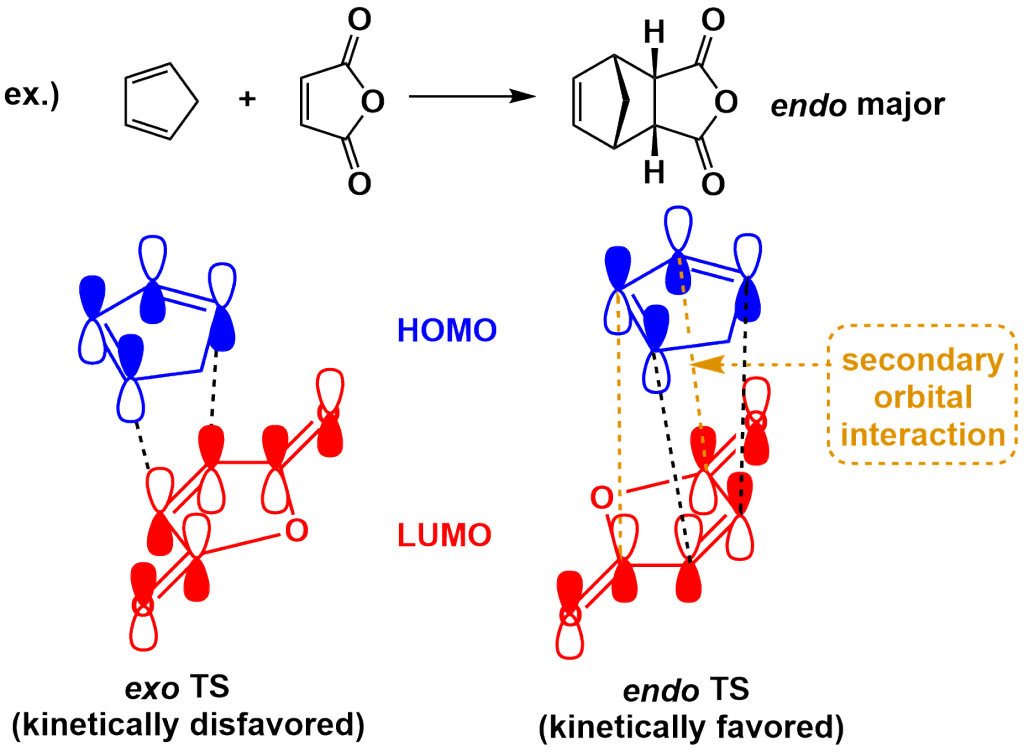
反応はcis付加様式で協奏的に進み、endo付加体が優先的に得られます(endo則)。通常電子要請型の場合には二次軌道相互作用で一応の説明がなされますが、endo/exo選択性は立体的影響を大きく受けるため、基質によっては完全にexo選択的に進むこともあります。とりわけ、環状配座に固定された分子内Diels-Alder反応などでは、コンフォメーションの自由度が低いため、endo則が当てはまらないことも多々あります。
有機電子論からも予測されるように、Diels-Alder付加体の置換基はオルト位/パラ位を占めるように位置選択的に付加します(オルト・パラ則)。より詳細にはFrontier軌道法を用いて説明がなされます。すなわち、HOMO/LUMOの係数が大きい反応点同士が重なるように付加が進行します。
環状遷移状態においてジエンはs-cis(cisoid)配座をとって付加します。s-trans(transoid)配座からはDiels-Alder反応は進行しません。たとえば下記の反応においてZ-1,3-pentadieneはs-cis配座をとりにくいため、反応性はE体にくらべ著しく低下します。
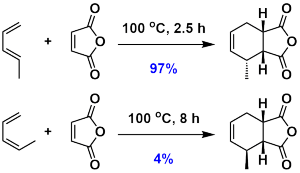
反応例
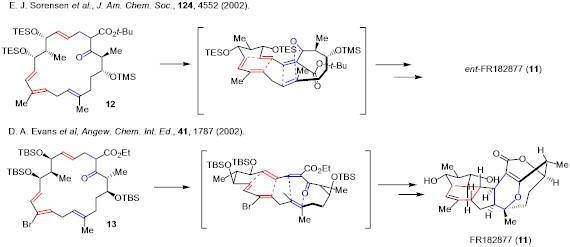
近年ではDiels-Alder反応を利用した生合成模倣経路での全合成(Biomimetic Total Synthesis)が数多く報告されています。例えば、SorensenおよびEvansの両グループは分子内Diels-Alder反応を鍵反応とするFR182877の全合成を達成しています。
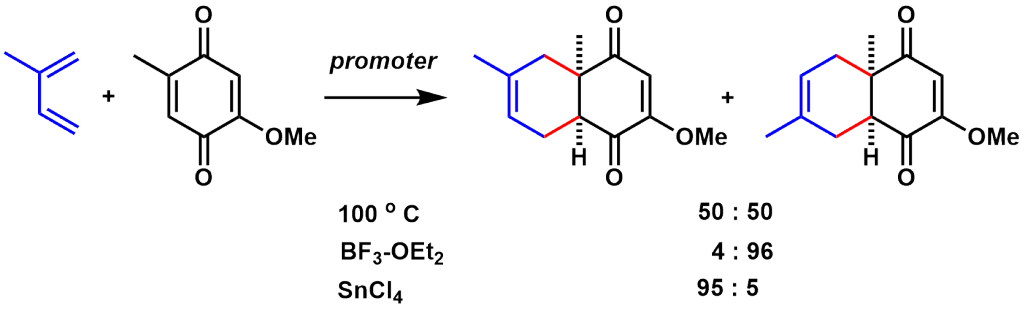
用いるルイス酸によって位置選択性が異なる例が知られています(キレート可能かどうかで、基質への結合位置が変わるため)。
プロスタグランジン類の合成
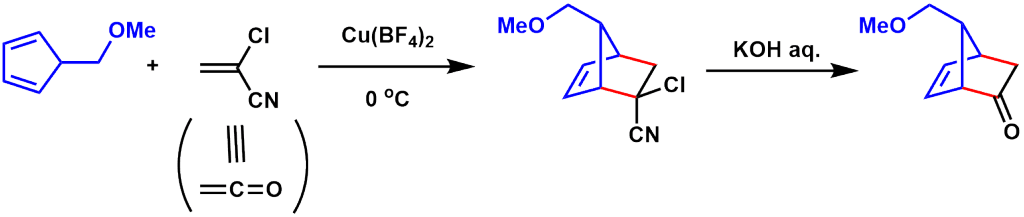
α-クロロアクリロニトリルはDiels-Alder反応におけるケテン等価体として機能します。
vibsanine骨格への応用例2)
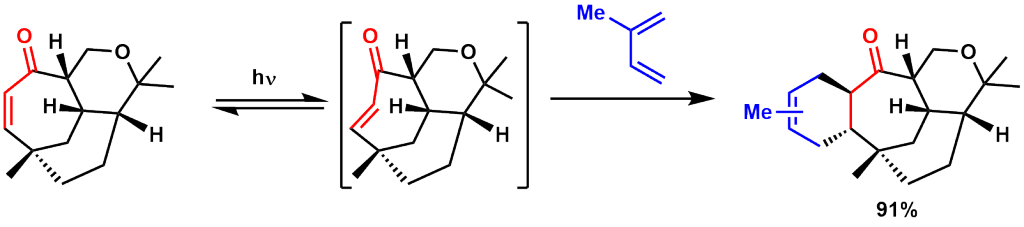
環状エノンに光照射して生じるひずんだジエノフィルはDiels-Alder反応の良い基質となり、通常とは異なるtrans縮環で目的物を与えます。
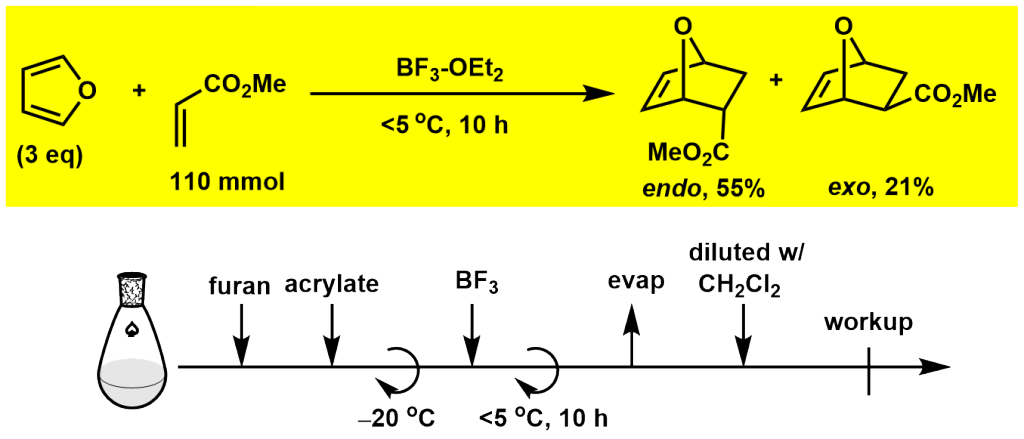
実験手順
フランとアクリル酸メチルを用いるDiels-Alder反応1)
実験のコツ・テクニック
ジエンの重合を防ぐために、弱塩基(ジメチルアニリンなど)や酸化防止剤(ヒドロキノンなど)を加えて反応を行う場合も多々あります。
参考文献
- Kotsuki, H., Asao, K. and Ohnishi, H. : Bull. Chem. Soc. Jpn., 57, 3339 (1984). doi:10.1246/bcsj.57.3339
- Davies, H. M. L., Loe, O. and Stafford, D. G. : Org. Lett., 7, 5561 (2005). DOI: 10.1021/ol052005c
基本文献
- Diels, O. and Alder, K.: Liebigs Ann. Chem., 460 , 98(1928). DOI:10.1002/jlac.19284600106
- Diels, O. and Alder, K.: Liebigs Ann. Chem., 470 , 62(1929).
- Diels, O. and Alder, K.: Ber., 62 , 2081, 2087(1929).
- Yamabe, S. and Minato, T.: J. Org. Chem., 65, 1830(2000). DOI: 10.1021/jo9919310
review
- Kloetzel, M. C.: Org. React., 4, 1(1948).
- Holms, H. L.: Org. React., 4, 60(1948).
- Butz, L. W. and Rytina, A. W.: Org. React., 5, 136(1949).
- Martin, J. G.: Chem. Rev., 61, 537(1961). DOI:10.1021/cr00013a013
- Brieger, G. and Bennett, J. N.: Chem. Rev., 80, 63(1980). DOI: 10.1021/cr60323a004
- Sauer, J. and Sustman, R.: Angew. Chem. Int. Ed. Engl., 19, 779(1980). DOI: 10.1002/anie.198007791
- Fallis, A.G.: Can. J. Chem., 62, 183(1984). doi:10.1139/v84-037
- Ciganek, E.: Org. React., 32, 1(1984).
- Oppolzer, W.: Comp. Org. Syn., 5, 315(1991).
- Roush, W. R.: Comp. Org. Syn., 5, 513(1991).
- Kumar, A.: Chem. Rev., 101, 1(2001). DOI: 10.1021/cr990410+
- Bear, B. R., Sparks, S. M. and Shea, K. J.: Angew. Chem. Int. Ed., 40, 820(2001).[abstract]
- Fringuelli, F., Piermatti, O., Pizzo, F. and Vacaro, L.: Eur. J. Org. Chem., 439(2001).[abstract]
- Hilt, G.: Synthesis, 2091(2005). DOI: 10.1055/s-2005-872084
- Wessig, P. and Muller, G.: Chem. Rev., 108, 2051(2008). DOI: 10.1021/cr0783986
- Reymond, S. and Cossy, J.: Chem. Rev., 108, 5359(2008). DOI: 10.1021/cr078346g
- Nair, V., Menon, R. S., Biju, A. T. and Abhilash, K. G.: Chem. Soc. Rev., 41, 1050(2012). DOI: 10.1039/C1CS15186J
review for applications to complex molecule/material synthesis
- Nicolaou, K. C., Synder, S. A., Montagnon, T. and Vassilikogiannakis, G.: Angew. Chem. Int. Ed., 41, 668(2002).[abstract]
- Takao, K.-i., Munakata, R. and Tadano, K.-i.: Chem. Rev., 105, 4779(2005). DOI: 10.1021/cr040632u
- Juhl, M. and Tanner D.: Chem. Soc. Rev., 38, 2983(2009). DOI: 10.1039/B816703F
- Kotha, S., Meshram, M. and Tiwari, A.: Chem. Soc. Rev., 38, 2065(2009). DOI: 10.1039/B810094M
- Tasdelen, M. A.: Polym. Chem., 2, 2133(2011). DOI: 10.1039/C1PY00041A
- Funel, J.-A. and Abele, S.: Angew. Chem. Int. Ed., 52, 3822(2013). DOI: 10.1002/anie.201201636
- Zydziak, N., Yameen, B. and Barner-Kowollik, C.: Polym. Chem., 4, 4072(2013). DOI: 10.1039/C3PY00232B
- Nawrat, C. C. and Moody, C. J.: Angew. Chem. Int. Ed., 53, 2056(2014). DOI: 10.1002/anie.201305908
- Mackay, E. G. and Sherburn, M. S.: Synthesis, 47, 1(2015). DOI: 10.1055/s-0034-1378676
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



