キナーゼ
キナーゼ はりん酸化酵素とも呼ばれ、ATPなどに含まれる「りん酸基」を特定の化合物に転移し、りん酸化合物を生じる反応を触媒する酵素の総称です。特にタンパク質をりん酸化するキナーゼをプロテインキナーゼと呼び、タンパク質の重要な翻訳後修飾の役割を担っています。キナーゼの異常はがんを始めとする様々な疾患の原因となっており、創薬のシーズ探索における重要なターゲット分子です。当社ではカルナバイオサイエンスの高活性なキナーゼを幅広くラインアップしています。
学術コンテンツ
キナーゼ はりん酸化酵素とも呼ばれ、ATPなどに含まれる「りん酸基」を特定の化合物に転移し、りん酸化合物を生じる反応を触媒する酵素の総称です。特にタンパク質をりん酸化するキナーゼをプロテインキナーゼと呼び、タンパク質の重要な翻訳後修飾の一つを担っています。
りん酸化によるタンパク質活性の制御
細胞において、りん酸化はタンパク質の活性制御に良く用いられます。タンパク質を構成するアミノ酸の内、セリン、スレオニン、チロシンの側鎖がりん酸化の標的となります。これらの側鎖の水酸基(-OH)がりん酸基に置き換わるとタンパク質の立体構造が変化し、それに伴って活性も変化します。
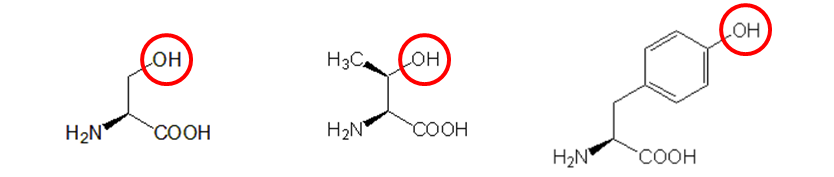
図1 アミノ酸とりん酸化部位
左からセリン、スレオニン、チロシン。赤丸はりん酸化を受ける側鎖の水酸基。
プロテインキナーゼ
ヒトにはプロテインキナーゼをコードする遺伝子が518種類存在します1)。プロテインキナーゼはりん酸化するアミノ酸残基によってセリン/スレオニンキナーゼ (Serine/Threonine Kinase/STK)とチロシンキナーゼ (Tyrosine Kinase / TK) に大きく分けることができます。
セリン/スレオニンキナーゼ
セリン/スレオニンをりん酸化するキナーゼです。全プロテインキナーゼの約80%を占め、細胞内の多彩なシグナル伝達に関与しています。
AGCグループ (Protein kinase A, G, C)
cAMP、cGMP、脂質などのセカンドメッセンジャーによって制御されるキナーゼ群です。
CAMKグループ (Ca2+/calmodulin-dependent protein kinase)
カルシウム/カルモジュリン複合体が結合することで活性化するキナーゼ群です。
CK1グループ (Casein Kinase 1)
体内に広く分布し、多くの基質をりん酸化します。常に活性型として存在しています。
CMGCグループ
CDK、MAPK、GSK3、CLKを含むキナーゼ群です。細胞増殖性制御など多様な機能を持ちます。
STEグループ
MAPKカスケードに含まれるキナーゼに相同性を持つキナーゼ群です。
TKLグループ (Tyrosine Kinase Like)
チロシンキナーゼに配列相同性が高いセリン/スレオニンキナーゼです。セリン/スレオニンキナーゼの多くは非受容体型ですが、このグループには受容体型も存在します。
チロシンキナーゼ
チロシンをりん酸化するキナーゼです。細胞外にリガンド受容体をもち、リガンド依存的に活性化される受容体型チロシンキナーゼと、別の受容体と共役して機能する非受容体型チロシンキナーゼに大別されます。
その他
配列から真核生物のキナーゼに分類されますが、上記のグループに属さないキナーゼもあります。
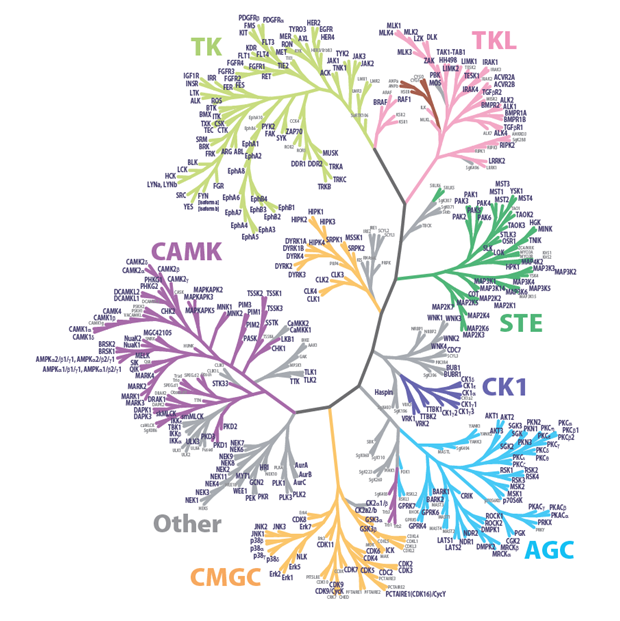
図2 キナーゼの分子系統樹
STKファミリー(STE、CK1、AGC、CMGC、CAMK、RGCおよびTKL)とTKファミリーに大別される。
太字で記載されているキナーゼは2020年3月時点でカルナバイオサイエンスより購入可能なキナーゼ。
脂質キナーゼ
イノシトールやスフィンゴシンなどの脂質をりん酸化する酵素です。
脂質キナーゼ
キナーゼと創薬
キナーゼは細胞内シグナル伝達において重要な役割を担っています。通常の細胞では、外部から信号(刺激)を受けると、キナーゼは別のキナーゼをりん酸化して、細胞の増殖、分裂、死亡等の指令を出します。
キナーゼに異常が生じると外部からの刺激に関係なく、突如、異常キナーゼが働きだし、細胞の増殖等の指令を出します。異常なキナーゼは、指令を出し続けるので、必要以上に細胞が増殖等してしまいます。このことからキナーゼの異常はさまざまな疾患の原因であると考えられており、製薬企業ではキナーゼを標的にした創薬研究が行われています。特にがん領域では2001年にBcr-Abl阻害剤であるImatinibがFDAに承認されたのを皮切りに、これまでに40以上ものキナーゼ阻害剤が抗がん剤として上市されています。
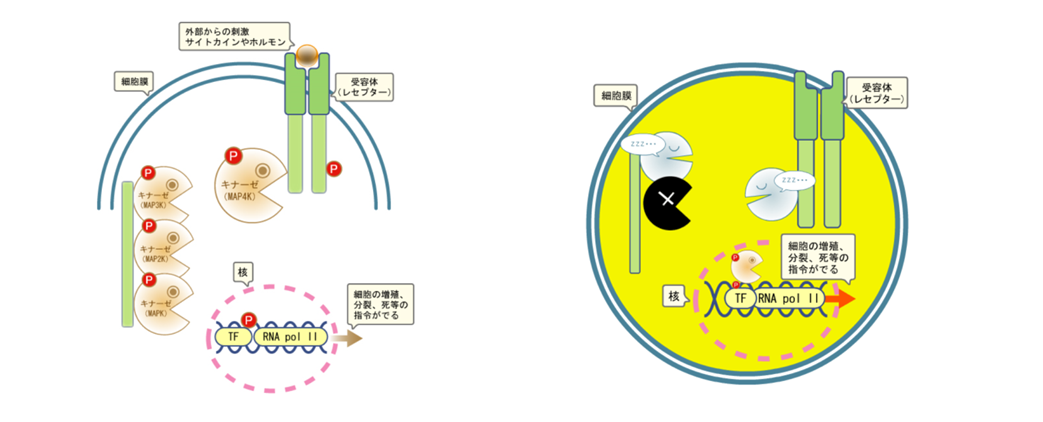
図3 正常なキナーゼ(左)と異常なキナーゼ(右)
カルナバイオサイエンス 「キナーゼの働きと病気」より転載
キナーゼ活性を上げる4つの方法
キナーゼをターゲットにした創薬シーズの探索では、使用するキナーゼがきちんと活性を示すということが前提になります。しかし、大腸菌はもちろん昆虫細胞を使用しても単にキナーゼを発現させただけでは活性が検出できないケースも存在します。
カルナバイオサイエンスのキナーゼは以下のように活性が検出できるよう様々な工夫を施しており、市販のキナーゼを選択する際にはこのような処理を施しているメーカーから購入するのが望ましいと考えられます。
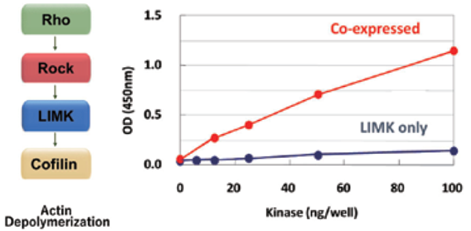
図4 RockとLIMKの共発現によるLIMK活性の違い
上流キナーゼとの共発現
MAPキナーゼのように、りん酸化カスケード中で上流のキナーゼによってりん酸化を受けるキナーゼを取得する場合には、発現時に上流のキナーゼと共発現させることで活性のあるキナーゼを得ることが可能です。
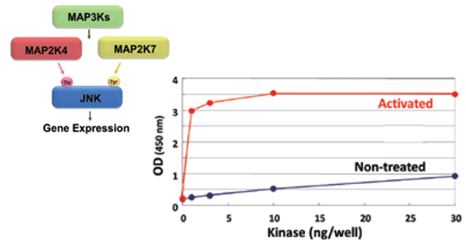
図5 MAP2K4およびMAP2K7とのプレインキュベーションによるJNK活性の違い
プレインキュベーション
受容体型チロシンキナーゼなど、アゴニスト刺激により活性化されるキナーゼは、細胞で発現後アゴニスト刺激を加えることが理想的ですが、膜タンパク質を単離することは容易ではありません。そこでカルナバイオサイエンスでは受容体型チロシンキナーゼの細胞内ドメインのみを作成し、自己リン酸化を促すようにATP 存在下でインキュベートした後精製することによって活性を高めているものがあります。
その他にもATP 存在下で上流キナーゼとインキュベートした後に再度精製を行うことにより活性のあるキナーゼを得る方法もあります (図5)。
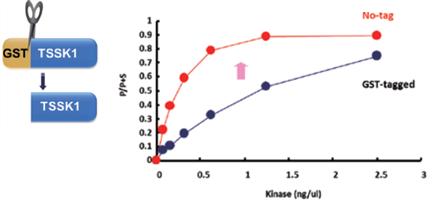
図6 GSTタグの切断によるTSSK1活性の違い
タグの切断
アフィニティータグ (エピトープタグ) はキナーゼの精製を容易にしますが、活性に影響を与える可能性もあります。このような場合、精製後にキナーゼからタグを切断することが有効です。
カルナバイオサイエンスのキナーゼには主にGSTタグ (26kDa) が使用されており、さらにGSTタグを切り離せるよう、PreScission Protease (Cytiva社) 切断サイトを入れています。必要に応じてタグを切断し、活性を高めています (図6)。
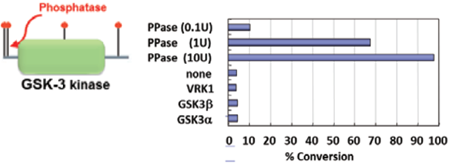
図7 フォスファターゼ処理によるGSK活性の回復
脱りん酸化処理
GSK3のように特定部位 [Ser21 (GSK3a), Ser9 (GSK3b)] がりん酸化されることにより、キナーゼ活性が低下するケースもあります。このようなキナーゼの場合、脱りん酸化処理によって活性を取り戻すことができます (図7)。
参考文献
- Manning, Gerard, et al. "The protein kinase complement of the human genome." Science 298.5600 (2002): 1912-1934.
- カルナバイオサイエンス CARNA COFFEE BREAK TECHNICAL NOTE No.1 リン酸化酵素活性を持つキナーゼ作成のお話



